- 2012年度
- 大脳皮質の進化の謎に迫る
(2013/03/29) - 活性型ビタミンDで小胞体ストレスを緩和しよう!
(2013/03/29) - Sweat Glands Grown from Newly Identified Stem Cells
(2013/03/29) - ~筋肉の恒常性と健康は相反するものなのか?~ 筋肉においてオートファジーが存在するが故にインスリン抵抗性が存在する
(2013/03/29) - たった1つの因子の抑制で様々な細胞が神経に!?
(2013/03/28) - 乳酸菌を取り込むと、細胞も若返る?! ~"人間、またしても発酵食品のお世話になる"の巻~
(2013/03/27) - 脳腫瘍における新しい遺伝子変異~エピジェネティク
(2013/03/27) - CCR2-dependentrecruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα
(2013/03/25) - 補体C1qはWntシグナルの活性化を介して細胞を老化させる
(2013/03/19) - Speramtogonial Stem Cell Transplantation into Rhesus Testes Regenerates Spermatogenesis Producing Functional Sperm.
(2013/03/12) - 糖尿病薬剤による抗腫瘍効果
(2013/03/12) - 難病ALSの新たな原因遺伝子の発見
(2013/03/12) - 脊髄損傷にヒートショックプロテインが有効?
(2013/03/11) - 片頭痛患者では血管内皮前駆細胞が少ない?
(2013/03/11) - 筋幹細胞の静止状態はmiRNA-489により維持される
(2013/03/11) - ストレスに弱いってどういうこと?(心の病気にかかるメカニズムの一つ、「ストレス脆弱モデル」をネズミで再現)
(2013/03/09) - 核酸医薬は実現するか~筋強直性ジストロフィー治療の可能性~
(2013/03/09) - なくならないのは技がある!
(2013/03/08) - Down症候群のiPS細胞の染色体数を修正する
(2013/03/08) - 高品質なiPS細胞作製のキーファクターZscan4の同定
(2013/03/08) - Turning off the Neuron Death Pathway
(2013/03/07) - 新しい安全な分子標識-マルチ同位体画像質量分析法-が明らかにした幹細胞の不等分裂様式
(2013/03/07) - 重度脊髄損傷後に移植した神経幹細胞が非常に長く軸索を伸長し、シナプス結合した!
(2013/03/07) - 神経系前駆細胞を元気にして水頭症を治す!?
(2013/03/05) - FUS/TLSとTDP-43 二つのALS原因遺伝子の交差点
(2013/03/01) - 貪食細胞マクロファージが造血幹細胞を優しく包み込んで自己複製能の維持に貢献していた!?
(2013/02/27) - TALENs -新遺伝子改変技術が生命科学を変える!?-
(2013/02/27) - RESTタンパク質による遺伝子発現調節 ~遺伝子発現とシナプス機能~
(2013/02/25) - 腸に住んでいるある平凡な細菌によって大腸がんは引き起こされる!
(2013/02/25) - 癌抑制遺伝子p53の変異はメバロン酸経路を活性化することで、正常な乳腺の構造を失わせる
(2013/02/25) - 樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛解させる
(2013/02/25) - Schwann Cell Plasticity After Spinal Cord Injury Shown by Neural Crest Lineage Tracing
(2013/02/15) - エクソソームは、癌細胞の「飛び道具」!
(2013/02/08) - 老化したニッチでは筋肉幹細胞は静止状態を保てない
(2013/01/31) - 幹細胞を使った創薬開発
(2013/01/31) - 体細胞リプログラミングにおける遺伝子発現調節の解析からわかること-single cellで見てみようの巻-
(2013/01/31) - がん幹細胞発生のかぎを握るのは誰?-ユーイング肉腫がん幹細胞の解析を通じた検証-
(2013/01/31) - 小動物用PET(Positron Emission Tomography)で、ラットの脳梗塞巣を探知することができる [18F]BMS-PET
(2013/01/31) - 脳の神経ネットワークにおけるヤングパワー!
(2013/01/18) - アストロサイトの性格はどうやって決まる?
(2013/01/18) - 幹細胞の自己複製能を制御する因子とは?
(2013/01/18) - アルデヒドが真犯人!?DNA損傷と再生不良性貧血
(2012/12/18) - HIV-2の新しい定量法
(2012/12/18) - Japanese People's Preference for Place of End-of-Life Care and Death: A Population-Based Nationwide Survey
(2012/12/18) - がん細胞の死に際
(2012/12/18) - 癌幹細胞を眠りから目覚めさせる"Coco"
(2012/12/13) - 細胞接着分子のインテグリンが血液の幹細胞の維持を制御する
(2012/12/11) - 移植された神経幹細胞は免疫系にも作用する
(2012/12/11) - 血液がん克服にむけて!~JAK2阻害剤の薬剤耐性メカニズム解明~
(2012/12/04) - 癌進展を陰で操る支配者
(2012/11/30) - 幹細胞の2つの顔を暴け!!! 未分化性維持と特異的分化との狭間で...
(2012/11/30) - 脊髄損傷後の機能回復には自発的なリハビリが効果的
(2012/11/21) - もしあなたの歯が無くなってしまった時に...
(2012/11/15) - iPS細胞から血小板をつくる
(2012/10/30) - メラノーマのエキソソームで予後予測ができる?!
(2012/10/30) - Oligodendroglia Cells Can Do Much More Than an Insulator for Neuron
(2012/09/11) - APJは、心臓肥大のデュアル受容体として作用する
(2012/09/11) - 幹細胞医療;脳梗塞治療への挑戦
(2012/09/11) - 造血幹細胞の老化と若返り
(2012/09/11) - カロリー制限が筋肉を増やす? - トレーニング界の常識に挑戦する新たな"逆説"
(2012/09/11) - 癌幹細胞は治療標的にならない!?
(2012/08/24) - iPS細胞でC型肝炎ウイルス感染のモデルをつくる
(2012/08/09) - ES細胞、iPS細胞から内耳有毛細胞への分化誘導
(2012/08/09) - 造血幹細胞を冬眠させる細胞はなんと神経系の細胞だった!
(2012/07/06) - 個別化治療への障壁 ~多重人格なガンを克服せよ~
(2012/07/06) - 栄養のバランスが新しいニューロンを作り、体重や新陳代謝をコントロールする
(2012/05/11) - 脊髄不全損傷後におこる、残存神経ネットワークの代償機能
(2012/05/11) - "スーパーPTENマウス"
(2012/04/20) - 統合失調症iPS細胞研究が臨床研究になるために
(2012/04/20) - 発癌機序における"はじめの一歩"
(2012/04/06) - iPS細胞は脊髄損傷を治せるのか?
(2012/04/06)
- 大脳皮質の進化の謎に迫る
- 2011年度
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 大脳皮質の進化の謎に迫る
大脳皮質の進化の謎に迫る
論文紹介著者

津山 淳(博士課程 2年)
GCOE RA
生理学教室
第一著者名・掲載雑誌・号・掲載年月
Sungbo Shim/Nature. 486:74-9, 2012 May
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Sungbo Shim,Kenneth Y. Kwan,Mingfeng Li,Veronique Lefebvre & Nenad Sestan. Cis-regulatory control of corticospinal system development and evolution. Nature 486, 74-79
論文解説
大脳皮質は思考や感情、随意運動などを含む、高次機能と呼ばれるものを司っています。この大脳皮質の発達により人間は様々なことを考えたり、物を投げることや発声のように複雑な運動を行うことを可能にしています。ヒトは身体能力こそ他の動物達に劣りますが、大きな大脳皮質が与えてくれた優れた高次機能を武器にすることで地球上に繁栄しました。
つまり、大脳皮質は進化の末に我々が手にした最大の武器といえます。
その大脳皮質は進化の過程においてどのようにして獲得されていったのか?
今回の論文の筆者たちはこの長年の謎に迫っていきます。
大脳皮質は6枚の層から構成されている
我々ヒトを含む哺乳類の大脳皮質はバームクーヘンみたいに6枚の層構造から成り立っていることが知られています(図1)。その中でも、5層や6層といった深部のニューロン達は、中枢神経系(※1)の遠い場所に軸索を伸ばすことが知られています。
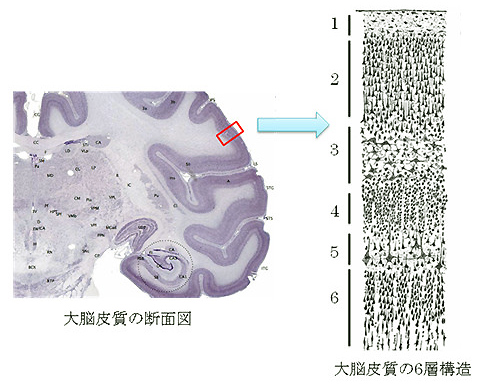
図1. Wikipedia 英語版 Cerebral cortexより改変引用
その中でも彼らが今回着目したのは「皮質脊髄路(※2)を構成する第5層ニューロン」。皮質脊髄路はほとんどが運動ニューロンから構成されており、その軸索は第5層から脊髄まで一気に投射しています。
一体どのようにして第5層のニューロンだけがそのような性質を獲得しているのでしょうか?
大脳皮質は層ごとに発現する遺伝子が決められている!
大脳皮質ニューロンはその皮質層特異的な遺伝子が発現することが知られています。そのことによってニューロンは決められた部位に移動し、決められた部位に投射し、複雑な大脳皮質の構造を維持しているのです。
一体どのようにして皮質層のニューロン達の遺伝子発現は制御されているのでしょうか?
そのメカニズムは幾つかありますが、今回彼らが注目したポイントが「エンハンサー」です。
DNAという材料から構成されるゲノムには遺伝子として発現する部分、つまりDNAからRNAへと転写され実際に機能する部分はゲノム全体からすればごくわずかな領域しかありません。しかし、ゲノム上にはどの遺伝子が転写されるのかを制御している領域があります。これをシスエレメントと呼びます。シスエレメントには遺伝子の発現に必須であるプロモーターと、発現の部位や強度を調整するエンハンサーと呼ばれる領域に大別することができます(図2)。近年、組織特異的な遺伝子発現にはエンハンサーが大きく関与してしていることが分かってきました。
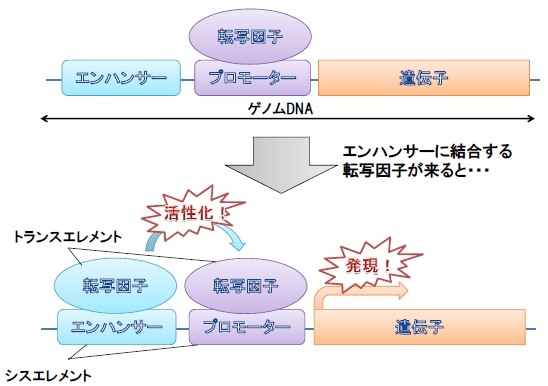
図2. 遺伝子発現におけるエンハンサーの役割
エンハンサーを必要としない遺伝子も数多く存在しますが、組織特異的な
遺伝子の発現は多くの場合エンハンサーによって制御されていています
皮質脊髄路を作り出す遺伝子Fezf2
大脳皮質はその皮質層特異的な転写因子(※3)が発現することが知られています。
中でもFezf2と呼ばれる転写因子は、主に以下に記す2つの特徴から皮質脊髄路を構成する第5層ニューロンに重要な遺伝子であると考えられています。
- Fezf2を破壊されたマウスは皮質第5層のニューロンが欠失する。
- Fezf2を第2あるいは第3層ニューロンに強制発現すると、第5層の運動ニューロンに似たニューロンになる。
しかしながら、このFezf2は大脳皮質が発達していない両生類や、魚類にいたるまで多くの種が持っています!
そこで筆者らは、このFezf2の発現を制御している領域を同定することによって、第5層ニューロンが哺乳類において誕生したメカニズムを明らかにしようと考えました。
Fezf2発現調節領域の同定
彼らはFezf2の制御領域を同定するために、Fezf2の周囲のゲノム配列を用意して、Fezf2の代わりにGFPと呼ばれる蛍光タンパク質ハメ込んだものを使用しました。例えば、この配列をゲノムに組み込まれたマウスを作ることで、Fezf2を発現している領域を緑色に光らせることができます(図3)。このようなマウスをレポーターマウスと呼びます。
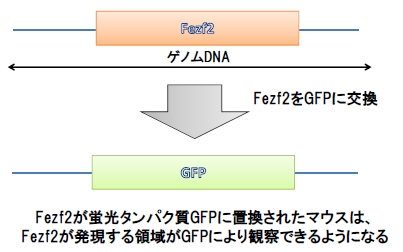
図3. Fezf2レポーターマウス解説
Fezf2近傍のDNA20万塩基対の配列をマウスに入れると、Fezf2の発現をよく再現しているマウスが生まれることが知られていたので、筆者らは「この20万塩基対のどこかにFezf2の発現を制御している領域が含まれている!」と考えました。
その20万塩基対を調べると、哺乳類において特に保存度高い領域が4か所見つかりました。それらの領域を順番にE1~E4と名付けました。
彼らは次にE1~E4をそれぞれ欠損させたFezf2レポーターマウスを作製しました。
するとE4を欠損させたときのみ、皮質脊髄路におけるGFPの発現が消失していることが見出されました。つまりE4領域がFezf2の発現を制御することで第5層のニューロンが作られていたことが分かったのです(図4)。
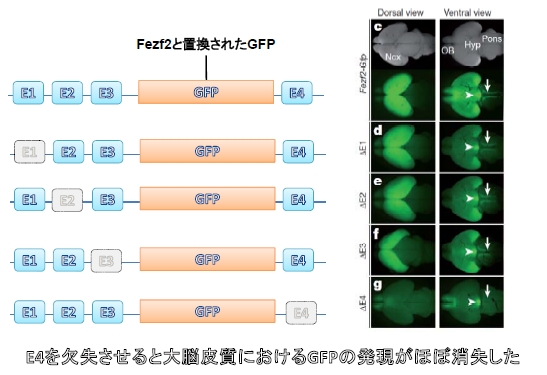
図4. Fig1より改変引用.
E4がなくなるとFezf2の代わりに導入されたGFPの発現が消えてしまいました
E4に結合する転写因子の同定
次に筆者らは、E4に結合する転写因子をコンピューター予測と遺伝子発現データーベースを用いて探索しました。その結果、Sox4とSox11という遺伝子が候補として上がってきました。
そこで大脳皮質でSox4とSox11が欠失するマウスを作製したところ、Sox4とSox11が両方欠失させたときのみ皮質脊髄路が欠損することが分かりました。
つまり、E4にはSox4かSox11のどちらかが結合することによりFezf2の発現が調節されていたことが分かりました(図5)。
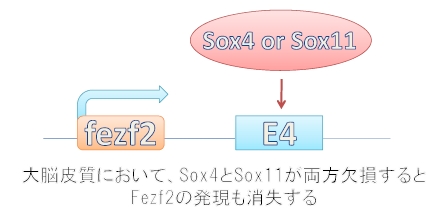
図5. 大脳皮質第5層におけるFezf2発現機構概略図.
E4にSox4あるいはSox11が結合することでFezf2を発現させます。
下等生物には存在しないE4配列の獲得が大脳皮質の形成に重要である!
ここまでの実験でE4配列が皮質脊髄路のニューロンを含む大脳皮質第5層の発生に必須であることを明らかにしてきました。
続いて彼らは他の生物のE4を調べてみたところ、マウスからヒトにいたるまでE4は保存されていましたが、大脳皮質があまり発達していないカエルや、ゼブラフィッシュなどの魚類はE4配列を持っていないことが分かりました。また、皮質脊髄路が形成されないFezf2が欠損したマウスに、ゼブラフィッシュのFezf2を代わりに発現させると皮質脊髄路が作られることが分かりました。つまり、Fezf2の働き自体が進化によって変わった訳では無く、あくまでもE4という発現調節領域を獲得したことが大脳皮質の進化において重要なターニングポイントになったことが示唆されました。
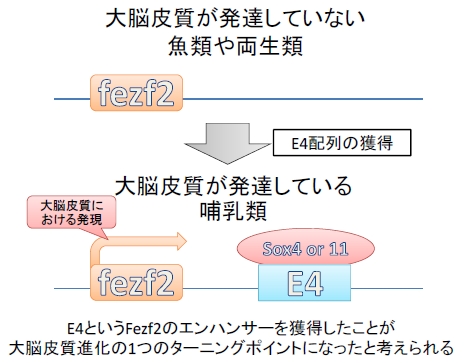
図6.まとめ
生物の進化には遺伝子の種類の増加以外にも、今回示したような遺伝子発現調節領域であるシスエレメントの進化も非常に重要な側面となります。タンパク質になる遺伝子の種類自体は、驚くべきことに線虫のような単純な生物とヒトとで大きく違いはありません。しかしながら、ヒトのゲノムは線虫の約30倍大きいことが挙げられます。これはヒトと線虫における大きな差です。この大きなゲノムには無数のシスエレメントが存在しており、このシスエレメントによる精密な遺伝子発現制御が生物の複雑性に重要であるという説が唱えられています。本論文は実際に脳の発生と進化に重要なシスエレメントを同定して、分子レベルで証明した重要な研究であるといえます。
しかし、まだまだシスエレメントの研究は明らかになっていないことが沢山あります。最近ではのエンハンサーがどの遺伝子を活性化してるか網羅的に調べることができるChIA-PET(※4)と呼ばれる手法も開発されています。今後このようなパワフルな方法を用いることで新しい知見がどんどん明らかになっていくことが期待されています。
用語解説
- ※1 中枢神経系:
神経系の中でも、脳と脊髄を指す。それ以外の部位の神経は末梢神経系と呼ばれる。 - ※2 皮質脊髄路:
大脳皮質から脊髄まで一気に投射する錐体ニューロンの軸索から形成される。皮質脊髄路を構成するニューロンは長いニューロンの代表格である。このニューロンは延髄で左右の反対側にほとんどが乗り換えることが知られている。これにより右半身は左脳に、左半身は右脳に支配されることになる。 - ※3 転写因子:
DNA結合領域を持つタンパク質で、結合した部分の遺伝子発現を制御している。シスエレメントに働きかける物質をトランスエレメントと呼ぶので、トランスエレメントの一つでもある。 - ※4 ChIA-PET:
Chromatin Interaction Analysis by Paired-End Tag Sequencingの略。
直訳するとペア-エンドタグ配列によるクロマチン相互作用解析。DNAとタンパク質をホルマリンなどで結合させ、超音波装置で破砕する。さらにDNAの切れ端にタグを付けて再結合させることで、細胞内で近接していたDNA領域を同定することができる手法。この手法を用いれば、結合配列同士が100万塩基対離れていても、隣の染色体から来ていようが同定することが可能である。
Copyright © Keio University. All rights reserved.
