- 2012年度
- 大脳皮質の進化の謎に迫る
(2013/03/29) - 活性型ビタミンDで小胞体ストレスを緩和しよう!
(2013/03/29) - Sweat Glands Grown from Newly Identified Stem Cells
(2013/03/29) - ~筋肉の恒常性と健康は相反するものなのか?~ 筋肉においてオートファジーが存在するが故にインスリン抵抗性が存在する
(2013/03/29) - たった1つの因子の抑制で様々な細胞が神経に!?
(2013/03/28) - 乳酸菌を取り込むと、細胞も若返る?! ~"人間、またしても発酵食品のお世話になる"の巻~
(2013/03/27) - 脳腫瘍における新しい遺伝子変異~エピジェネティク
(2013/03/27) - CCR2-dependentrecruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα
(2013/03/25) - 補体C1qはWntシグナルの活性化を介して細胞を老化させる
(2013/03/19) - Speramtogonial Stem Cell Transplantation into Rhesus Testes Regenerates Spermatogenesis Producing Functional Sperm.
(2013/03/12) - 糖尿病薬剤による抗腫瘍効果
(2013/03/12) - 難病ALSの新たな原因遺伝子の発見
(2013/03/12) - 脊髄損傷にヒートショックプロテインが有効?
(2013/03/11) - 片頭痛患者では血管内皮前駆細胞が少ない?
(2013/03/11) - 筋幹細胞の静止状態はmiRNA-489により維持される
(2013/03/11) - ストレスに弱いってどういうこと?(心の病気にかかるメカニズムの一つ、「ストレス脆弱モデル」をネズミで再現)
(2013/03/09) - 核酸医薬は実現するか~筋強直性ジストロフィー治療の可能性~
(2013/03/09) - なくならないのは技がある!
(2013/03/08) - Down症候群のiPS細胞の染色体数を修正する
(2013/03/08) - 高品質なiPS細胞作製のキーファクターZscan4の同定
(2013/03/08) - Turning off the Neuron Death Pathway
(2013/03/07) - 新しい安全な分子標識-マルチ同位体画像質量分析法-が明らかにした幹細胞の不等分裂様式
(2013/03/07) - 重度脊髄損傷後に移植した神経幹細胞が非常に長く軸索を伸長し、シナプス結合した!
(2013/03/07) - 神経系前駆細胞を元気にして水頭症を治す!?
(2013/03/05) - FUS/TLSとTDP-43 二つのALS原因遺伝子の交差点
(2013/03/01) - 貪食細胞マクロファージが造血幹細胞を優しく包み込んで自己複製能の維持に貢献していた!?
(2013/02/27) - TALENs -新遺伝子改変技術が生命科学を変える!?-
(2013/02/27) - RESTタンパク質による遺伝子発現調節 ~遺伝子発現とシナプス機能~
(2013/02/25) - 腸に住んでいるある平凡な細菌によって大腸がんは引き起こされる!
(2013/02/25) - 癌抑制遺伝子p53の変異はメバロン酸経路を活性化することで、正常な乳腺の構造を失わせる
(2013/02/25) - 樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛解させる
(2013/02/25) - Schwann Cell Plasticity After Spinal Cord Injury Shown by Neural Crest Lineage Tracing
(2013/02/15) - エクソソームは、癌細胞の「飛び道具」!
(2013/02/08) - 老化したニッチでは筋肉幹細胞は静止状態を保てない
(2013/01/31) - 幹細胞を使った創薬開発
(2013/01/31) - 体細胞リプログラミングにおける遺伝子発現調節の解析からわかること-single cellで見てみようの巻-
(2013/01/31) - がん幹細胞発生のかぎを握るのは誰?-ユーイング肉腫がん幹細胞の解析を通じた検証-
(2013/01/31) - 小動物用PET(Positron Emission Tomography)で、ラットの脳梗塞巣を探知することができる [18F]BMS-PET
(2013/01/31) - 脳の神経ネットワークにおけるヤングパワー!
(2013/01/18) - アストロサイトの性格はどうやって決まる?
(2013/01/18) - 幹細胞の自己複製能を制御する因子とは?
(2013/01/18) - アルデヒドが真犯人!?DNA損傷と再生不良性貧血
(2012/12/18) - HIV-2の新しい定量法
(2012/12/18) - Japanese People's Preference for Place of End-of-Life Care and Death: A Population-Based Nationwide Survey
(2012/12/18) - がん細胞の死に際
(2012/12/18) - 癌幹細胞を眠りから目覚めさせる"Coco"
(2012/12/13) - 細胞接着分子のインテグリンが血液の幹細胞の維持を制御する
(2012/12/11) - 移植された神経幹細胞は免疫系にも作用する
(2012/12/11) - 血液がん克服にむけて!~JAK2阻害剤の薬剤耐性メカニズム解明~
(2012/12/04) - 癌進展を陰で操る支配者
(2012/11/30) - 幹細胞の2つの顔を暴け!!! 未分化性維持と特異的分化との狭間で...
(2012/11/30) - 脊髄損傷後の機能回復には自発的なリハビリが効果的
(2012/11/21) - もしあなたの歯が無くなってしまった時に...
(2012/11/15) - iPS細胞から血小板をつくる
(2012/10/30) - メラノーマのエキソソームで予後予測ができる?!
(2012/10/30) - Oligodendroglia Cells Can Do Much More Than an Insulator for Neuron
(2012/09/11) - APJは、心臓肥大のデュアル受容体として作用する
(2012/09/11) - 幹細胞医療;脳梗塞治療への挑戦
(2012/09/11) - 造血幹細胞の老化と若返り
(2012/09/11) - カロリー制限が筋肉を増やす? - トレーニング界の常識に挑戦する新たな"逆説"
(2012/09/11) - 癌幹細胞は治療標的にならない!?
(2012/08/24) - iPS細胞でC型肝炎ウイルス感染のモデルをつくる
(2012/08/09) - ES細胞、iPS細胞から内耳有毛細胞への分化誘導
(2012/08/09) - 造血幹細胞を冬眠させる細胞はなんと神経系の細胞だった!
(2012/07/06) - 個別化治療への障壁 ~多重人格なガンを克服せよ~
(2012/07/06) - 栄養のバランスが新しいニューロンを作り、体重や新陳代謝をコントロールする
(2012/05/11) - 脊髄不全損傷後におこる、残存神経ネットワークの代償機能
(2012/05/11) - "スーパーPTENマウス"
(2012/04/20) - 統合失調症iPS細胞研究が臨床研究になるために
(2012/04/20) - 発癌機序における"はじめの一歩"
(2012/04/06) - iPS細胞は脊髄損傷を治せるのか?
(2012/04/06)
- 大脳皮質の進化の謎に迫る
- 2011年度
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 個別化治療への障壁 ~多重人格なガンを克服せよ~
個別化治療への障壁 ~多重人格なガンを克服せよ~
論文紹介著者

吉田 剛(博士課程 2年)
GCOE RA
先端医科学研究所 遺伝子制御部門
第一著者名・掲載雑誌・号・掲載年月
Marco Gerlinger M.D./N Engl J Med. 2012 Mar 8; 366(10): 883-92.
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Intratumor heterogeneity and branched evolution revealed by multiregion sequencing.
Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, Martinez P, Matthews N, Stewart A, Tarpey P, Varela I, Phillimore B, Begum S, McDonald NQ, Butler A, Jones D, Raine K, Latimer C, Santos CR, Nohadani M, Eklund AC, Spencer-Dene B, Clark G, Pickering L, Stamp G, Gore M, Szallasi Z, Downward J, Futreal PA, Swanton C.
SourceCancer Research UK London Research Institute, London, United Kingdom.
N Engl J Med. 2012 Mar 8;366(10):883-92.
論文解説
臨床の現場で癌患者の個別化治療を推進していくためには、腫瘍の種類や進行期を診断したうえで確立されたプロトコール通りの外科的切除、化学療法、あるいは放射線療法を行う必要があります。その際に、針を使って腫瘍検体を採取(needle biopsyと呼称されます)して病理学的に解析することが重要と考えられてきました。しかしながら、腫瘍組織を構成する癌細胞は均一な集団ではなくポリクローナルであることが問題視されてきました。これを腫瘍内ヘテロ不均一性(intratumoral heterogeneity; ※1)と呼びます。腫瘍組織を構成する細胞集団が不均一である原因としては従来、確率論的に癌化に関与する遺伝子変異が加わることであるというstochastic model(確率論モデル)が長年の間、広く支持されてきました。しかし、自己複製能、多分化能を有する正常組織幹細胞と酷似した腫瘍細胞が存在することが乳癌や白血病などの幅広い癌腫において証明されて以来、腫瘍内ヘテロ不均一性が生じる原因には、癌幹細胞(cancer stem cell; CSC)が頂点となり、そこから派生する自己複製能を喪失した分化傾向を有する細胞によって支持されるというhierarchy model(階層性モデル)が主流になりつつあります(図1)。どちらが正しい説なのかさえ定かではありませんし、あくまで腫瘍の「多重人格」性が如何にして成立するのかということを説明する「モデル(model)」に過ぎないことに注意してください。いずれにせよ、腫瘍組織は「多重人格」な遺伝子発現プロフィールを有する細胞から構成されるといえるでしょう。
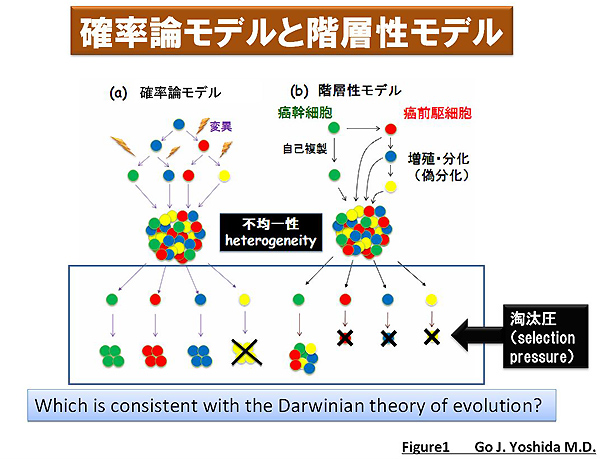
図1
さらに注目すべきこととして、腫瘍組織内で癌細胞は決して仲良く協調的な良友関係にあるわけではありません。確率論的に新規遺伝子に変異が生じたりエピジェネティックな変化(epigenetic change;※2)な変化が加わるにせよ、癌幹細胞から多様性に派生したにせよ、異なるクローンはお互いに生存、増殖を賭けて争い合う修羅場なのです。そこへ分子標的薬が投与されると特定のシグナルや癌遺伝子に依存しているクローン(この状態を「oncogene addiction」と呼称します)は特異的に消滅し、生存した別のクローンが登場するわけです。臨床現場では「高額の分子標的薬で治療したのに、さらに腫瘍の悪性度が増した」という重大な問題に直面することになるわけです。もしも治療するたびに治療に抵抗性を示す異なる腫瘍細胞のクローンがたびたび台頭するのであれば、「watch and wait (待期的治療)」が第一選択となるのでしょうか?手出しすればするほど、泥沼に嵌っていくのでしょうか?(図2)
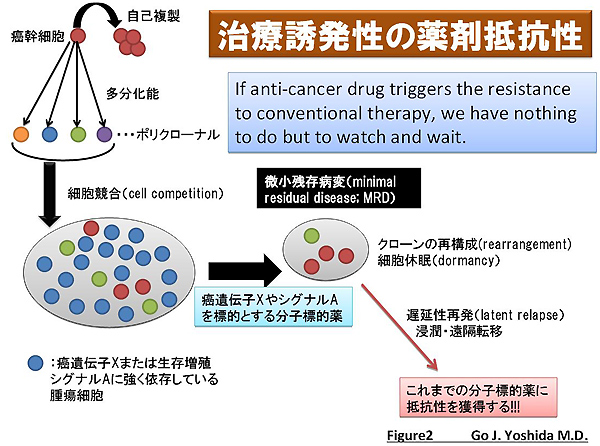
図2
今回の論文では、腫瘍組織を構成する細胞集団が不均一である原因は従来、確率論的に癌化に関与する遺伝子変異が加わることであるというstochastic model(確率論モデル)が重要なのではないかという「確率論モデルへの原点回帰」の要素がある点で非常に興味深いので紹介することにしました。一回の針生検からの病理学的診断では「樹を見て森を見ず」・・・腫瘍全体の一部を解析するだけでは、その腫瘍に有効な治療法を断定することはできないということです(図3)。
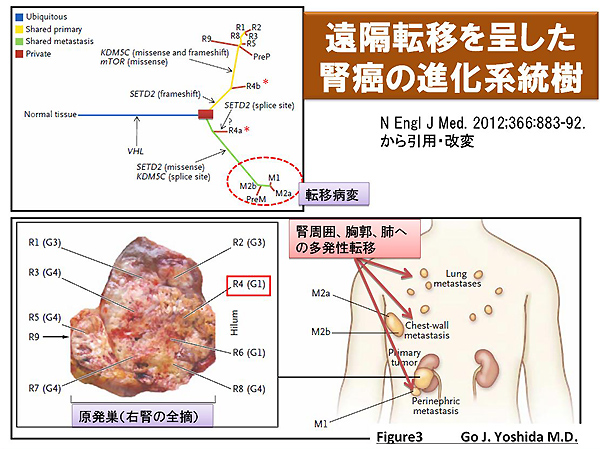
図3
そこで本論文では、mTOR阻害剤(※3)であるeverolimus(エベロリムス)を投与しても治療効果が現れず、結局のところ、遠隔転移を呈したため腎癌(組織型は典型的な組織型である淡明細胞癌;clear cell carcinoma)を腎臓ごと手術切除(nephrotectomy)した症例に着目しました。原発巣を空間的に10種類に、そして肺や胸郭などの転移巣を3種類に分類して、網羅的に遺伝子発現の違いを評価することのできるマイクロアレイ法を用いて解析、検証しました。さらに筆者らは共通する遺伝子変異、その領域にだけ特異的に見られる遺伝子変異を区別することで系統樹(evolutionary tree)を作製しました(図3)。系統樹に沿って今回の腎癌症例を振りかえってみましょう。腎癌発症に必須といわれているVHL(von Hippel-Lindau)遺伝子はいずれの領域でも変異を認めており「■」が進化論的に最初の分岐点となっています。注目すべきこととして、R4aとR4b(図3で「*」)とでは、空間的には腎臓内で隣接してはいますが、系統樹では起源(origin)が全く異なることが強く示唆されました。さらに系統樹では、R4のSETD(H3K36のトリメチル化酵素)やmTORのミスセンス変異が腎周囲、胸郭、肺への多発性転移病変と酷似しており、R4bから肺などへの遠隔転移病変が形成された可能性が高いと考えられます。すなわち、驚くべきことに、原発巣である腎癌のうち隣接する領域でもだいぶ遺伝子発現が異なっていることが分かり、一概に「空間的に近距離だからといって遺伝子発現プロフィールも類似しているとは限らない」ことが明らかになりました。
また筆者らはeverolimusが働きかけるmTORシグナル伝達に関する検討をマイクロアレイや組織免疫染色を用いて行いました。すると、一部の領域では恒常的にmTORシグナルが活性化する変異(機能獲得型変異; gain-of-functional mutation)を認めました。このような領域の腫瘍細胞では、いくらmTOR阻害剤を投与しても生存増殖を抑えられないことがin vitro レベルの検証で分かりました。具体的にmTORシグナルの活性化指標としてリン酸化S6(※4)を用いますが、血清を加えていない培地(serum-free condition)にすると、急速にmTOR活性が低下します(図4)。しかしmTOR遺伝子にL2431Pという点突然変異(point mutation)が存在する原発巣領域R5では、栄養が少なくても非常に強いmTOR活性が保持されていることが判明しました(図4)。すわなち、こうした領域はeverolimus抵抗性を獲得していることになります。治療経過中にmTORの変異が生じた可能性も考えられます。いずれにせよ、薬剤感受性のある領域は死滅し、薬剤抵抗性のある領域の腫瘍細胞が生存していくわけです。
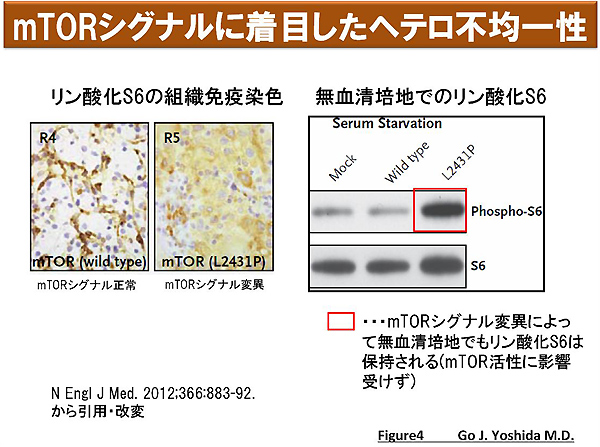
図4
『種の起源(origin of species)』で「自然選択説 (natural selection theory)」を唱えたチャールズ・ロバート・ダーウィン(Charles Robert Darwin)の名前を引用して、筆者らは腫瘍組織内におけるこの多様性の変化を"Darwinian selection"(※5)と定義づけました。一般的に細胞や個体がある環境で生存していくためには選択圧、または淘汰圧(selective pressure)と呼ばれる障壁を乗り越えていかねばなりません。例えば、低酸素刺激で活性化するHIF1-α(hypoxia-inducible factor alpha)とそれが転写を誘導する遺伝子群があまり働かない腫瘍細胞のクローンでは、血管新生が不十分な領域では「低酸素」という選択圧によって死滅することになります。
進化生物学的には個体が形質を変化させるには短くても数千年、長ければ億年単位のレベルでの時間が必要となります。しかし、腫瘍細胞は内在するゲノム不安定性による遺伝子変異誘発性やエピジェネティックな変化による環境への高度な適応能力によって、短期間に進化を遂げて他の腫瘍細胞クローンと細胞競合して勝ち残ろうとする、「多重人格性」を有する、進化論的に最強の生物なのかもしれません。問題点は、分子標的薬の安易な投与がこの「進化」を加速化している危険性があることです。今回の論文は、このように環境適応性の高い「腫瘍」という生物にどのようにして立ち向かうべきなのかを、われわれ研究者、臨床医は常に考え続けなければいけないという警笛に思えました。
用語解説
- ※1 腫瘍内ヘテロ不均一性:
癌細胞の形質を変化させる新たな遺伝子変異や、酸化ストレス・低酸素刺激をはじめとする微小環境からのストレスによるエピジェネティックな変化を遂げることで、生物学的特性の異なった多様な腫瘍細胞が出現すると考えられています。こうして腫瘍組織は細胞レベルにおける不均一性(heterogeneity)を呈することになります。上述したように原因としては確率論モデルと階層性モデルの2つが主に提唱されていますが、本論文では確率論モデル(「進化論モデル」の方が適当な名称かもしれません...)を強く支持する重要なデータが掲載されました。 - ※2 エピジェネティックな変化:
ゲノムDNAのメチル化修飾と、ゲノムDNAと複合体を形成するヒストンタンパク質(H2A, H2B, H3, H4各々2個ずつからなる8量体です)のメチル化修飾、アセチル化修飾に大別されます。主に外部刺激(腫瘍間質からの酸化ストレスや不十分な血管新生による低酸素刺激など)によって惹起されます。例えば、小児に好発する網膜芽細胞腫(retinoblastoma)の原因遺伝子である癌抑制遺伝子Rbの不活性化は、Rb遺伝子のプロモーター領域が高度にメチル化されることでRbタンパクの発現が顕著に減少することが原因とされています。
=Topics; ドラッグホリデー(drug holiday)について=
治療誘発性の薬剤抵抗性のメカニズムについて図2で説明しました。一見、不可逆的な現象に見えますが、薬剤ストレスによってエピジェネティックな変化が起きた場合はそうとは限りません。例えばチロシンキナーゼ阻害剤(【例】頭頸部癌や肺癌の治療に用いるEGFR阻害剤)が効かなくなってきた際は、投薬をいったん中止します。これをドラッグホリデー(drug holiday)と呼びます。1週間ほどすると治療抵抗性の原因となっていたヒストンのメチル化などが解除されて、再びチロシンキナーゼ阻害剤の効果が認められることはしばしばあります。既にこの手法は臨床腫瘍学の現場では常識となっています。 - ※3 mTOR阻害剤:
mTORシグナルはセリン/スレオニンキナーゼに属しており、転写やタンパク質の合成、細胞の成長や増殖などの多彩な機能に重要な働きをしている。これまでは免疫抑制剤として臓器移植後の拒絶反応を抑制するべく広く処方されてきました。しかし近年になって、mTORシグナルに強く依存する癌種が存在することが報告されるにつれて抗癌剤としてもmTOR阻害剤の有用性も認識されるようになりました。本論文で登場する経口mTOR阻害剤であるeverolimusは 転移病変を有する進行期の腎癌患者に対する分子標的治療薬として2010年に日本国内で承認されました。 - ※4 リン酸化S6:
真核生物の細胞質に存在するリボソーム(ribosome)は、40Sサブユニットと60Sサブユニットのヘテロダイマ-でありタンパク質合成において必須のシグナル伝達分子です。成長因子(growth factor)や細胞分裂促進因子(mitogen)は、S6キナーゼ(p85/p70 S6 kinase)の活性化とそれに伴うS6基質のリン酸化を誘導します。 - ※5 Darwinian selection:
ヘテロ不均一性に多彩な遺伝子背景を有する細胞や個体が、お互いの生存をかけた競合や環境由来のストレス(選択圧/淘汰圧; selective pressure)などによって選択的に淘汰される現象を指す進化生物学の単語です。この現象の一例を進化論で説明すると、恐竜が栄えた時代にある日突然に天候が悪化して十分な量の食物が手に入らなくなり、個体の大きい恐竜は死滅し、生態系は小さなサイズの哺乳類に取って代わられたわけです。腫瘍生物学では、例えば、ある癌遺伝子に生存増殖が高度に依存しているoncogene-addictiveな腫瘍細胞では、その癌遺伝子や関連するシグナルを遮断するだけで容易に消滅する一方で、他の生存・増殖シグナルに依存している細胞は生存して微小残存病変(minimal residual disease; MRD)を構成し、再発や転移の原因となるわけです。
Copyright © Keio University. All rights reserved.
