- 2012年度
- 大脳皮質の進化の謎に迫る
(2013/03/29) - 活性型ビタミンDで小胞体ストレスを緩和しよう!
(2013/03/29) - Sweat Glands Grown from Newly Identified Stem Cells
(2013/03/29) - ~筋肉の恒常性と健康は相反するものなのか?~ 筋肉においてオートファジーが存在するが故にインスリン抵抗性が存在する
(2013/03/29) - たった1つの因子の抑制で様々な細胞が神経に!?
(2013/03/28) - 乳酸菌を取り込むと、細胞も若返る?! ~"人間、またしても発酵食品のお世話になる"の巻~
(2013/03/27) - 脳腫瘍における新しい遺伝子変異~エピジェネティク
(2013/03/27) - CCR2-dependentrecruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα
(2013/03/25) - 補体C1qはWntシグナルの活性化を介して細胞を老化させる
(2013/03/19) - Speramtogonial Stem Cell Transplantation into Rhesus Testes Regenerates Spermatogenesis Producing Functional Sperm.
(2013/03/12) - 糖尿病薬剤による抗腫瘍効果
(2013/03/12) - 難病ALSの新たな原因遺伝子の発見
(2013/03/12) - 脊髄損傷にヒートショックプロテインが有効?
(2013/03/11) - 片頭痛患者では血管内皮前駆細胞が少ない?
(2013/03/11) - 筋幹細胞の静止状態はmiRNA-489により維持される
(2013/03/11) - ストレスに弱いってどういうこと?(心の病気にかかるメカニズムの一つ、「ストレス脆弱モデル」をネズミで再現)
(2013/03/09) - 核酸医薬は実現するか~筋強直性ジストロフィー治療の可能性~
(2013/03/09) - なくならないのは技がある!
(2013/03/08) - Down症候群のiPS細胞の染色体数を修正する
(2013/03/08) - 高品質なiPS細胞作製のキーファクターZscan4の同定
(2013/03/08) - Turning off the Neuron Death Pathway
(2013/03/07) - 新しい安全な分子標識-マルチ同位体画像質量分析法-が明らかにした幹細胞の不等分裂様式
(2013/03/07) - 重度脊髄損傷後に移植した神経幹細胞が非常に長く軸索を伸長し、シナプス結合した!
(2013/03/07) - 神経系前駆細胞を元気にして水頭症を治す!?
(2013/03/05) - FUS/TLSとTDP-43 二つのALS原因遺伝子の交差点
(2013/03/01) - 貪食細胞マクロファージが造血幹細胞を優しく包み込んで自己複製能の維持に貢献していた!?
(2013/02/27) - TALENs -新遺伝子改変技術が生命科学を変える!?-
(2013/02/27) - RESTタンパク質による遺伝子発現調節 ~遺伝子発現とシナプス機能~
(2013/02/25) - 腸に住んでいるある平凡な細菌によって大腸がんは引き起こされる!
(2013/02/25) - 癌抑制遺伝子p53の変異はメバロン酸経路を活性化することで、正常な乳腺の構造を失わせる
(2013/02/25) - 樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛解させる
(2013/02/25) - Schwann Cell Plasticity After Spinal Cord Injury Shown by Neural Crest Lineage Tracing
(2013/02/15) - エクソソームは、癌細胞の「飛び道具」!
(2013/02/08) - 老化したニッチでは筋肉幹細胞は静止状態を保てない
(2013/01/31) - 幹細胞を使った創薬開発
(2013/01/31) - 体細胞リプログラミングにおける遺伝子発現調節の解析からわかること-single cellで見てみようの巻-
(2013/01/31) - がん幹細胞発生のかぎを握るのは誰?-ユーイング肉腫がん幹細胞の解析を通じた検証-
(2013/01/31) - 小動物用PET(Positron Emission Tomography)で、ラットの脳梗塞巣を探知することができる [18F]BMS-PET
(2013/01/31) - 脳の神経ネットワークにおけるヤングパワー!
(2013/01/18) - アストロサイトの性格はどうやって決まる?
(2013/01/18) - 幹細胞の自己複製能を制御する因子とは?
(2013/01/18) - アルデヒドが真犯人!?DNA損傷と再生不良性貧血
(2012/12/18) - HIV-2の新しい定量法
(2012/12/18) - Japanese People's Preference for Place of End-of-Life Care and Death: A Population-Based Nationwide Survey
(2012/12/18) - がん細胞の死に際
(2012/12/18) - 癌幹細胞を眠りから目覚めさせる"Coco"
(2012/12/13) - 細胞接着分子のインテグリンが血液の幹細胞の維持を制御する
(2012/12/11) - 移植された神経幹細胞は免疫系にも作用する
(2012/12/11) - 血液がん克服にむけて!~JAK2阻害剤の薬剤耐性メカニズム解明~
(2012/12/04) - 癌進展を陰で操る支配者
(2012/11/30) - 幹細胞の2つの顔を暴け!!! 未分化性維持と特異的分化との狭間で...
(2012/11/30) - 脊髄損傷後の機能回復には自発的なリハビリが効果的
(2012/11/21) - もしあなたの歯が無くなってしまった時に...
(2012/11/15) - iPS細胞から血小板をつくる
(2012/10/30) - メラノーマのエキソソームで予後予測ができる?!
(2012/10/30) - Oligodendroglia Cells Can Do Much More Than an Insulator for Neuron
(2012/09/11) - APJは、心臓肥大のデュアル受容体として作用する
(2012/09/11) - 幹細胞医療;脳梗塞治療への挑戦
(2012/09/11) - 造血幹細胞の老化と若返り
(2012/09/11) - カロリー制限が筋肉を増やす? - トレーニング界の常識に挑戦する新たな"逆説"
(2012/09/11) - 癌幹細胞は治療標的にならない!?
(2012/08/24) - iPS細胞でC型肝炎ウイルス感染のモデルをつくる
(2012/08/09) - ES細胞、iPS細胞から内耳有毛細胞への分化誘導
(2012/08/09) - 造血幹細胞を冬眠させる細胞はなんと神経系の細胞だった!
(2012/07/06) - 個別化治療への障壁 ~多重人格なガンを克服せよ~
(2012/07/06) - 栄養のバランスが新しいニューロンを作り、体重や新陳代謝をコントロールする
(2012/05/11) - 脊髄不全損傷後におこる、残存神経ネットワークの代償機能
(2012/05/11) - "スーパーPTENマウス"
(2012/04/20) - 統合失調症iPS細胞研究が臨床研究になるために
(2012/04/20) - 発癌機序における"はじめの一歩"
(2012/04/06) - iPS細胞は脊髄損傷を治せるのか?
(2012/04/06)
- 大脳皮質の進化の謎に迫る
- 2011年度
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > CCR2-dependentrecruitment of macrop...
CCR2-dependentrecruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα
論文紹介著者

川村 直(博士課程 4年)
GCOE RA
先端医科学研究所細胞情報部門
第一著者名・掲載雑誌・号・掲載年月
Ren G/Cell Stem Cell 11, 812-824, December 7, 2012
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Ren G, Zhao X, Wang Y, Zhang X, Chen X, Xu C, Yuan ZR, Roberts AI, Zhang L, Zheng B, Wen T, Han Y, Rabson AB, Tischfield JA, Shao C, Shi Y.
Cell Stem Cell 11, 812-824, December 7, 2012
論文解説
はじめに
腫瘍組織には癌細胞に加えて、マクロファージ(Mφ)やT細胞をはじめとした免疫細胞、血管やリンパ管を構成している細胞、線維芽細胞や間葉系幹細胞などの細胞が存在し、「がん微小環境」を構築している(Fig.1 参照)。これら、がん微小環境を構成する細胞は、様々な増殖因子やサイトカイン、ケモカインを産生することで、がん幹細胞の維持やがん細胞の増殖、浸潤転移などを制御していることが判明している。このがん微小環境を構成している細胞集団の1つが、間葉系の細胞集団(Mesenchymal stem/stromal cell; MSC)である。既に胃の炎症性発癌モデルにおいて、腫瘍局所存在している、がん間質細胞のうち、約20%は骨髄に存在しているMSCに由来しているなど (2011年3月25日更新 「骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する」より)、MSCががん微小環境に及ぼす影響は大きい。これら腫瘍近傍に集積したMSCは、CCL5のようなケモカインやサイトカインを通して、がん細胞の転移促進や腫瘍の増殖を助けることが知られている。しかし、腫瘍におけるMSCと免疫担当細胞(T細胞やNK細胞、樹状細胞など)とMSCとの関係については解析が未だなされていない。今回紹介する論文は、腫瘍局所のMSCがCCL2というケモカインを産生し、CCR2(CCL2の受容体)を発現しているMacrophage(Mφ)を腫瘍内に浸潤させ、増腫瘍性の亢進に関連している事を示している。
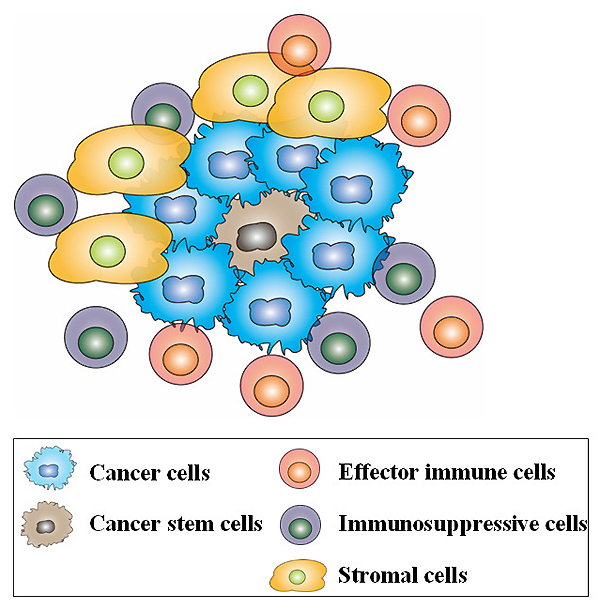
Fig.1 がん微小環境を構成する細胞たち
がんの形成過程では、がん細胞は免疫細胞や間質細胞などとの相互作用により、がんの進展に適した環境を構築する。近年、マクロファージや好中球など自然免疫に関係した細胞群ががんの進展を促進しているという報告がある。また、間葉系幹細胞(MSC)は骨髄から浸潤し、がん間質繊維芽細胞(CAF)へと変わり、がんを進展させる
腫瘍内浸潤したMSCは腫瘍の増大を促進する
腫瘍内浸潤したMSCは本当に腫瘍の増大に重要な細胞集団なのであろうか。そのことを確認するため、リンパ腫の自然発症マウスから腫瘍内に浸潤しているMSC (L-MSC; Lymphoma-derived MSC)を分離し、がん細胞との共移植の実験系で確認を行った。その結果、骨髄由来のMSC (BM-MSC; bone marrow-derived MSC)との共移植群や腫瘍単独移植群に比べ、L-MSCとの共移植群での増腫瘍性の亢進が確認された(Fig.2 参照)。
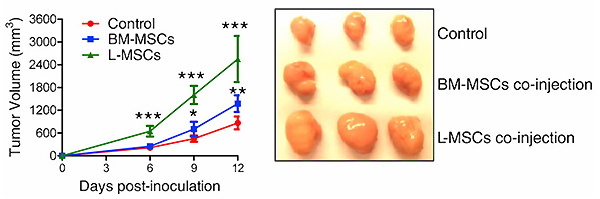
Fig.2 L-MSCとの共移植により腫瘍が増大する
MSCとEL-4を共移植することで、EL-4単独で移植するよりも増腫瘍性が増強される。正常の骨髄由来MSC(BM-MSC)でも増腫瘍性は増強されるが、それ以上にがん間質由来のMSC(L-MSC)の方が、増腫瘍性がより増強される。
L-MSC共移植群がコントロールやBM-MSC共移植群に比べ、増腫瘍性が亢進した原因は何であろうか。その一つの可能性が生体内での抗腫瘍免疫応答である。生体ではがんを排除するための免疫応答が起きているが、腫瘍による免疫抑制機構により抗腫瘍免疫応答が抑制され、腫瘍が増大することが知られている。実際、抗腫瘍免疫応答に重要なIFN-γやIL-12の血中濃度は、L-MSCないしBM-MSCとの共移植群においてコントロール群よりも低い。しかし、Splenocyte(脾臓細胞)に対する抑制効果に差は認められなかった(Fig.3 参照)。これら2種類のMSCは、抗腫瘍免疫応答は同じように抑制するものの、それ以外の作用によって増腫瘍性に差を及ぼしたことになる。
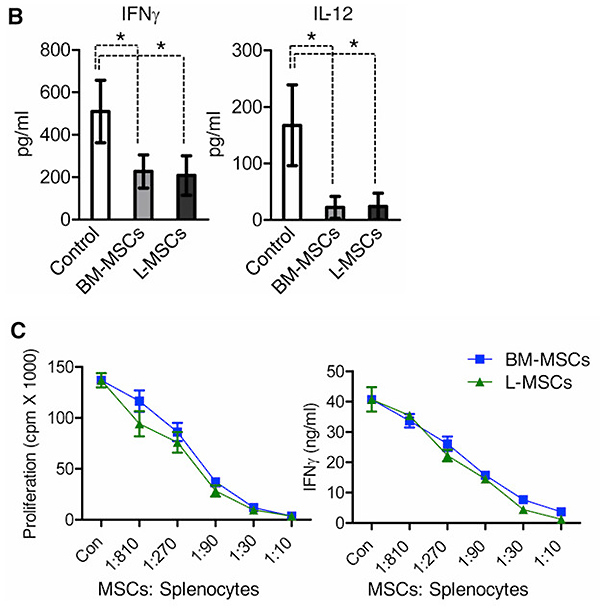
Fig.3 MSCは抗腫瘍免疫応答を抑制する
MSCとの共移植は腫瘍単独の移植よりも、血中のIFN-γやIL-12が低下する。これは、MSCが抗腫瘍免疫応答を抑制するためである。MSCはVEGFやTGF-bなどのサイトカインやPD-L1などの膜タンパクの発現することで、免疫応答を抑制する。BM-MSCにしてもL-MSCにしても免疫抑制能には大きな差がなく、両者ともに抑制活性が高い。
次に着目したのが、腫瘍局所における免疫抑制性の細胞集団である。腫瘍内浸潤したMφや好中球(neutrophil)は、血管新生や腫瘍で起こる抗腫瘍免疫応答を抑制し、増腫瘍性を促進することが知られている。そこで、腫瘍内に浸潤しているMφやneutrophilの細胞数を比較すると、L-MSC共移植群ではBM-MSC共移植群にくらべ、単球(CD11b+Ly6C+)やMφ(F4/80+CD206+)、neutrophil(CD11b+Ly6G+)が増加している事が判明した(Fig.4 参照)。これらのことより、L-MSCは免疫抑制性の細胞集団を腫瘍に浸潤させることで増腫瘍性を亢進させていたことが判明した。
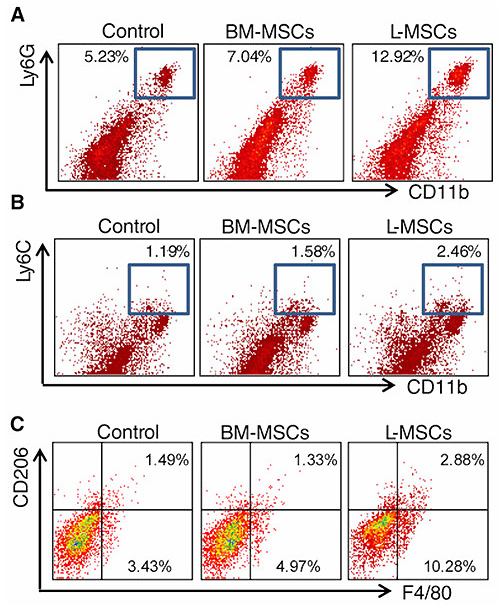
Fig.4 L-MSCは腫瘍近傍に免疫抑制性細胞を集積させ増腫瘍性を促進させる
L-MSCは単球由来の免疫抑制性細胞(MDSCやTAM)を腫瘍近傍に集積させ、増腫瘍性を促進させる。L-MSCはBM-MSCよりもCCL2を高産生しており、単球系の細胞を引き寄せる能力が高い。単球由来MDSC(CD11b+Ly6C+)や好中球由来(CD11b+Ly6G+)MDSC、Mφ(F4/80+CD206+)は抗腫瘍免疫を抑制するのみならず、血管新生をも促進することが知られている。
L-MSCはどのような分子機構で単球(CD11b+Ly6C+)やMφ(F4/80+CD206+)、neutrophil(CD11b+Ly6G+)を腫瘍内に引き寄せているのだろうか。そこで、L-MSCとBM-MSCが産生しているサイトカインやケモカインを網羅的に解析したところ、L-MSCではBM-MSCに比べ、ケモカインの一種であるCCL2(別名MCP-1)の発現が格段に高いことが見出された。CCL2は単球やMφなどの遊走に重要なケモカインであり、単球・Mφ・neutrophilにはCCL2の受容体であるCCR2が発現していることが知られている。
したがって、L-MSCはCCL2の産生を介して腫瘍局所に単球(CD11b+Ly6C+)やMφ(F4/80+CD206+)、neutrophil(CD11b+Ly6G+)を引き寄せて、腫瘍の進展を促進していることが判明した。実際、CCR2ノックアウトマウスやCCR2の中和抗体を用いた実験では、腫瘍内浸潤している、単球(CD11b+Ly6C+)やMφ(F4/80+CD206+)が減少し、増腫瘍性が抑制された。
TNF-αはMSCを腫瘍浸潤様のMSCへと変貌させる
このL-MSCとBM-MSCの性質の違いはどこから来るのであろうか?腫瘍内浸潤したMSCの起源の一つは骨髄に存在しているMSCである。腫瘍局所では、炎症性サイトカイン(TNF-α, IFN-γ, IL-1, IL-6)が亢進しており、これらサイトカインが腫瘍の増殖を促進している。そこで、腫瘍局所で産生されているサイトカインをBM-MSCに添加した際に、L-MSCと似た性質を得られるかを検討した。その結果、TNF-αを添加したBM-MSCはL-MSCと同じようにCCL2の産生が亢進した。TNF-αで前処置したBM-MSCをがん細胞と共移植すると、L-MSCと同様にCCR2+のMφ(F4/80+CD206+)の腫瘍内浸潤を促進させ、増腫瘍性に働いていることが示された。
以上まとめると、今回紹介した論文は、
- L-MSCはCCL2を高産生し、腫瘍内に単球やMacrophageを集積させて増腫瘍性の促進に働いている。
- BM-MSCにTNF-αを添加することでL-MSC様の増腫瘍性の性質をもったMSCへと変貌する。というものであった。
TNF-αで前処置しL-MSC様へと変化したMSCは本当に腫瘍増大だけに働くのであろうか。
今回紹介した論文の直後に、全く正反対の内容の論文が掲載されている(Lee RH et al, Cell Stem Cell. 2012 Dec 7;11(6):825-35.)。こちらの論文では、
- ヒトMSCにTNF-αを添加する事で、TRAIL(がん細胞にアポトーシスを誘導する膜分子)とDKK3(がん抑制遺伝子)の発現が上昇する。
- ヒト乳がん細胞をNOD/SCID mouseに移植したXenograftモデルにおいて、TNF-α前処置したMSCをadoptive transferすると、TRAILによりアポトーシス細胞の増加とDKK3によるがん細胞の増殖抑制が起こり、腫瘍が縮退する。
というデータを示している。
どちらの論文もMSCにTNF-αを添加する実験を行っているが、腫瘍に対する反応は正反対である。そもそもMSC自体は免疫抑制能が高く、重症GVHD に対する新しい細胞治療法として期待が集まっている。そのようなMSCが生体内でTNF-αによってTRAILの発現が上昇するのか。仮にTRAILの発現が上昇したとして、そのMSCが腫瘍の形成に一体どのような影響を与えるのか、ということについては解明されていない。
これらのことは、「ある局面」ではMSCは抗腫瘍にも増腫瘍にも働きうる、ということを示唆しており(Fig.5 参照)、今後はがん微小環境における継時的なMSCの機能解析により、MSCがどのタイミングで抗腫瘍から増腫瘍へと変化しうるのかについて解析していくことが重要であるように思われる。
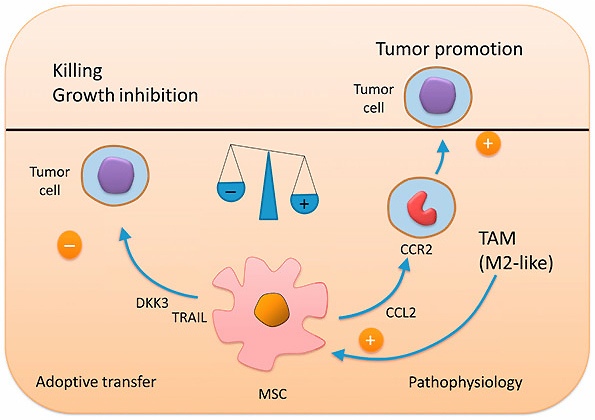
Fig.5 MSCは増腫瘍性にも抗腫瘍免疫応答増強にも働きうる
TNF-αで前処置したMSCは、増腫瘍にも抗腫瘍にも働きうる。今回、主に紹介した論文ではTNF-αで前処置することでCCL2の産生が上昇し、腫瘍内浸潤する免疫抑制性細胞が増加し増腫瘍性が亢進される。一方で、もう一つの論文ではMSCをTNF-αで前処置するとTRAILの発現が上昇し抗腫瘍に働く。がん微小環境におけるMSCの機能解析が今後、重要になってくる。
Copyright © Keio University. All rights reserved.
