- 2012年度
- 大脳皮質の進化の謎に迫る
(2013/03/29) - 活性型ビタミンDで小胞体ストレスを緩和しよう!
(2013/03/29) - Sweat Glands Grown from Newly Identified Stem Cells
(2013/03/29) - ~筋肉の恒常性と健康は相反するものなのか?~ 筋肉においてオートファジーが存在するが故にインスリン抵抗性が存在する
(2013/03/29) - たった1つの因子の抑制で様々な細胞が神経に!?
(2013/03/28) - 乳酸菌を取り込むと、細胞も若返る?! ~"人間、またしても発酵食品のお世話になる"の巻~
(2013/03/27) - 脳腫瘍における新しい遺伝子変異~エピジェネティク
(2013/03/27) - CCR2-dependentrecruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα
(2013/03/25) - 補体C1qはWntシグナルの活性化を介して細胞を老化させる
(2013/03/19) - Speramtogonial Stem Cell Transplantation into Rhesus Testes Regenerates Spermatogenesis Producing Functional Sperm.
(2013/03/12) - 糖尿病薬剤による抗腫瘍効果
(2013/03/12) - 難病ALSの新たな原因遺伝子の発見
(2013/03/12) - 脊髄損傷にヒートショックプロテインが有効?
(2013/03/11) - 片頭痛患者では血管内皮前駆細胞が少ない?
(2013/03/11) - 筋幹細胞の静止状態はmiRNA-489により維持される
(2013/03/11) - ストレスに弱いってどういうこと?(心の病気にかかるメカニズムの一つ、「ストレス脆弱モデル」をネズミで再現)
(2013/03/09) - 核酸医薬は実現するか~筋強直性ジストロフィー治療の可能性~
(2013/03/09) - なくならないのは技がある!
(2013/03/08) - Down症候群のiPS細胞の染色体数を修正する
(2013/03/08) - 高品質なiPS細胞作製のキーファクターZscan4の同定
(2013/03/08) - Turning off the Neuron Death Pathway
(2013/03/07) - 新しい安全な分子標識-マルチ同位体画像質量分析法-が明らかにした幹細胞の不等分裂様式
(2013/03/07) - 重度脊髄損傷後に移植した神経幹細胞が非常に長く軸索を伸長し、シナプス結合した!
(2013/03/07) - 神経系前駆細胞を元気にして水頭症を治す!?
(2013/03/05) - FUS/TLSとTDP-43 二つのALS原因遺伝子の交差点
(2013/03/01) - 貪食細胞マクロファージが造血幹細胞を優しく包み込んで自己複製能の維持に貢献していた!?
(2013/02/27) - TALENs -新遺伝子改変技術が生命科学を変える!?-
(2013/02/27) - RESTタンパク質による遺伝子発現調節 ~遺伝子発現とシナプス機能~
(2013/02/25) - 腸に住んでいるある平凡な細菌によって大腸がんは引き起こされる!
(2013/02/25) - 癌抑制遺伝子p53の変異はメバロン酸経路を活性化することで、正常な乳腺の構造を失わせる
(2013/02/25) - 樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛解させる
(2013/02/25) - Schwann Cell Plasticity After Spinal Cord Injury Shown by Neural Crest Lineage Tracing
(2013/02/15) - エクソソームは、癌細胞の「飛び道具」!
(2013/02/08) - 老化したニッチでは筋肉幹細胞は静止状態を保てない
(2013/01/31) - 幹細胞を使った創薬開発
(2013/01/31) - 体細胞リプログラミングにおける遺伝子発現調節の解析からわかること-single cellで見てみようの巻-
(2013/01/31) - がん幹細胞発生のかぎを握るのは誰?-ユーイング肉腫がん幹細胞の解析を通じた検証-
(2013/01/31) - 小動物用PET(Positron Emission Tomography)で、ラットの脳梗塞巣を探知することができる [18F]BMS-PET
(2013/01/31) - 脳の神経ネットワークにおけるヤングパワー!
(2013/01/18) - アストロサイトの性格はどうやって決まる?
(2013/01/18) - 幹細胞の自己複製能を制御する因子とは?
(2013/01/18) - アルデヒドが真犯人!?DNA損傷と再生不良性貧血
(2012/12/18) - HIV-2の新しい定量法
(2012/12/18) - Japanese People's Preference for Place of End-of-Life Care and Death: A Population-Based Nationwide Survey
(2012/12/18) - がん細胞の死に際
(2012/12/18) - 癌幹細胞を眠りから目覚めさせる"Coco"
(2012/12/13) - 細胞接着分子のインテグリンが血液の幹細胞の維持を制御する
(2012/12/11) - 移植された神経幹細胞は免疫系にも作用する
(2012/12/11) - 血液がん克服にむけて!~JAK2阻害剤の薬剤耐性メカニズム解明~
(2012/12/04) - 癌進展を陰で操る支配者
(2012/11/30) - 幹細胞の2つの顔を暴け!!! 未分化性維持と特異的分化との狭間で...
(2012/11/30) - 脊髄損傷後の機能回復には自発的なリハビリが効果的
(2012/11/21) - もしあなたの歯が無くなってしまった時に...
(2012/11/15) - iPS細胞から血小板をつくる
(2012/10/30) - メラノーマのエキソソームで予後予測ができる?!
(2012/10/30) - Oligodendroglia Cells Can Do Much More Than an Insulator for Neuron
(2012/09/11) - APJは、心臓肥大のデュアル受容体として作用する
(2012/09/11) - 幹細胞医療;脳梗塞治療への挑戦
(2012/09/11) - 造血幹細胞の老化と若返り
(2012/09/11) - カロリー制限が筋肉を増やす? - トレーニング界の常識に挑戦する新たな"逆説"
(2012/09/11) - 癌幹細胞は治療標的にならない!?
(2012/08/24) - iPS細胞でC型肝炎ウイルス感染のモデルをつくる
(2012/08/09) - ES細胞、iPS細胞から内耳有毛細胞への分化誘導
(2012/08/09) - 造血幹細胞を冬眠させる細胞はなんと神経系の細胞だった!
(2012/07/06) - 個別化治療への障壁 ~多重人格なガンを克服せよ~
(2012/07/06) - 栄養のバランスが新しいニューロンを作り、体重や新陳代謝をコントロールする
(2012/05/11) - 脊髄不全損傷後におこる、残存神経ネットワークの代償機能
(2012/05/11) - "スーパーPTENマウス"
(2012/04/20) - 統合失調症iPS細胞研究が臨床研究になるために
(2012/04/20) - 発癌機序における"はじめの一歩"
(2012/04/06) - iPS細胞は脊髄損傷を治せるのか?
(2012/04/06)
- 大脳皮質の進化の謎に迫る
- 2011年度
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > メラノーマのエキソソームで予後予測ができる?!
メラノーマのエキソソームで予後予測ができる?!
論文紹介著者

吉武 桃子(博士課程 4年)
GCOE RA
歯科・口腔外科学教室
第一著者名・掲載雑誌・号・掲載年月
Hector Peinado/Nature Medicine.18, 2012 June: 883-891
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Hector Peinado, Masa Alec kovic, Simon Lavotshkin, Irina Matei, Bruno Costa-Silva, Gema Moreno-Bueno, Marta Hergueta-Redondo, Caitlin Williams, Guillermo Garcia-Santos, Cyrus M Ghajar, Ayuko Nitadori-Hoshino, Caitlin Hoffman, Karen Badal, Benjamin A Garcia, Margaret K Callahan, Jianda Yuan9, Vilma R Martins, Johan Skog, Rosandra N Kaplan, Mary S Brady, Jedd D Wolchok, Paul B Chapman, Yibin Kang, Jacqueline Bromberg & David Lyden
Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET.
Nature Medicine.18, 2012 June: 883-891
論文解説
メラノーマは皮膚癌のなかでも非常に悪性度が高いことで知られています。初期であれば外科的に切除することで完治を見込めますが、転移性のメラノーマになると、治療抵抗性となり、非常に予後が悪くなります。しかし、メラノーマの進行を予期できるマーカーは知られていません。転移能や進行を予期できるマーカーがあれば、治療の可能性が広がるのではないでしょうか?
今回の論文では、腫瘍由来のエキソソームがメラノーマにおいて原発腫瘍と転移の形成に果たす役割を解析しています。エキソソームとは、30~100nmの小型膜小胞であり、マクロファージや樹状細胞などの免疫細胞や癌細胞をはじめ、多くの細胞がエキソソームを分泌することで遠く離れた細胞まで情報を伝達しているといわれています。
エキソソームは脂質二重膜で囲まれた膜小胞で、分泌細胞由来の膜蛋白質と細胞質成分で構成されています。増殖因子受容体などの細胞膜表面に存在するタンパク質がエンドサイトーシスによって細胞内に取り込まれ、初期エンドソーム、引き続き後期エンドソームが形成されます。後期エンドソーム膜がさらに内向きにくびれて形成される小さな腔内膜小胞が細胞膜と融合することにより、細胞外へと開口分泌されます。このような機構で分泌される小胞がエキソソームと呼ばれます。最近、腫瘍由来のエキソソームは、腫瘍形成メディエーターであることが新たに明らかになりつつあります。
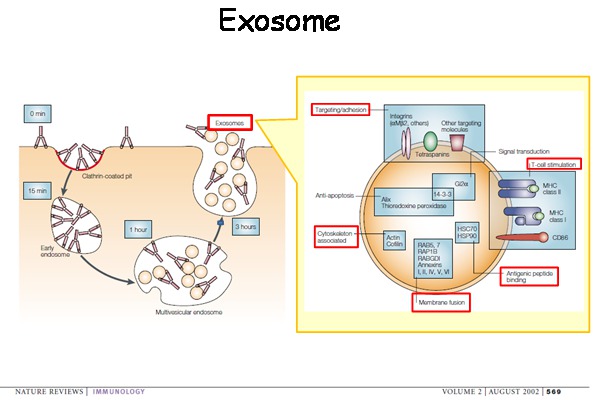
また、癌細胞が産生するサイトカインは肺などの転移先臓器で、骨髄由来の造血前駆細胞や間葉系幹細胞、内皮前駆細胞などの細胞を集め、線維芽細胞などの間質細胞を活性化させ、フィブロネクチンの産生により、癌細胞が転移しやすい環境 (pre-metastatic niche) を構築し、そこに癌細胞が転移巣を形成するという概念を今回の著者らのラボでは発表してきました。
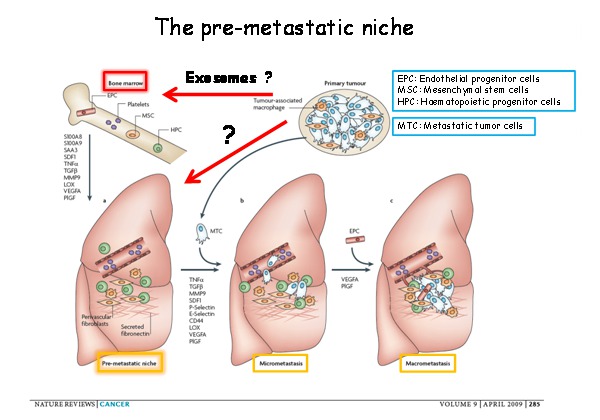
今回はメラノーマの転移の形成において、骨髄細胞や、肺などの転移先臓器におけるpre-metastatic nicheの形成に腫瘍由来のエキソソームが関与しているのではないかという仮説のもと、解析を進めていきます。
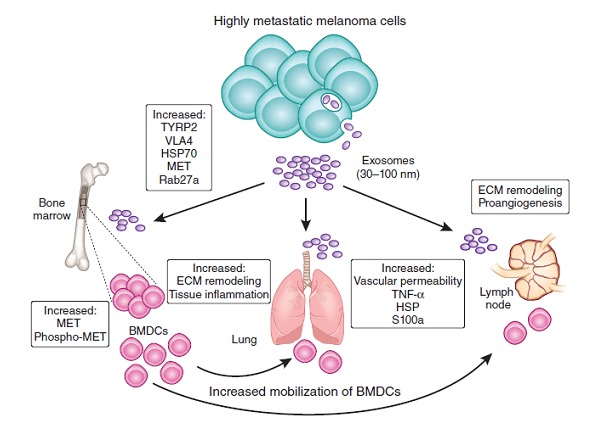
ステージの異なるメラノーマの患者さんから抽出したエキソソームを比較すると、ステージ4でエキソソームの分泌量が多いことがわかりました。また、ステージ3、4の患者さんのエキソソームで特異的に発現しているタンパクがあり、またそのタンパクの発現の量によって、一部予後予測ができることがわかりました。非常に転移性が高いメラノーマのエキソソームは、受容体型チロシンキナーゼMETを介して、骨髄前駆細胞を絶えず「教育」することによって原発腫瘍の転移挙動を増加させました。メラノーマ由来のエキソソームはまた、転移前の部位(pre-metastatic niche)で血管漏出を誘導し、骨髄前駆細胞をMetが陽性である血管形成誘導型の表現型へと再プログラム化しました。エキソソームでのMet発現を低下させると、骨髄細胞の転移誘発的挙動が消失しました。特に、転移性メラノーマ患者さんの循環中にある骨髄前駆細胞では、METの発現が上昇していました。膜輸送とエキソソーム形成の調節因子である RAB27A は、メラノーマ細胞で高度に発現していることがわかりました。 Rab27A のRNA干渉による発現抑制はエキソソーム産生を低下させて、骨髄細胞の「教育」が阻止され、腫瘍増殖と転移が低減しました。進行した転移性メラノーマの患者さんから派生したエキソソームは、TYRP2、VLA-4、HSP70、MET、Rab27a蛋白質を高濃度に含んでいることがわかり、エキソソーム特異的なメラノーマの特徴を明らかにしました。これは、予後予測と治療に使える可能性があります。
このように、メラノーマにおいて、エキソソームの産生と輸送・骨髄細胞の誘導は腫瘍増殖と転移を促し、予後予測に重要で、転移過程における新たな治療管理に展望を与えることを示しています。
Copyright © Keio University. All rights reserved.
