- 2012年度
- 大脳皮質の進化の謎に迫る
(2013/03/29) - 活性型ビタミンDで小胞体ストレスを緩和しよう!
(2013/03/29) - Sweat Glands Grown from Newly Identified Stem Cells
(2013/03/29) - ~筋肉の恒常性と健康は相反するものなのか?~ 筋肉においてオートファジーが存在するが故にインスリン抵抗性が存在する
(2013/03/29) - たった1つの因子の抑制で様々な細胞が神経に!?
(2013/03/28) - 乳酸菌を取り込むと、細胞も若返る?! ~"人間、またしても発酵食品のお世話になる"の巻~
(2013/03/27) - 脳腫瘍における新しい遺伝子変異~エピジェネティク
(2013/03/27) - CCR2-dependentrecruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα
(2013/03/25) - 補体C1qはWntシグナルの活性化を介して細胞を老化させる
(2013/03/19) - Speramtogonial Stem Cell Transplantation into Rhesus Testes Regenerates Spermatogenesis Producing Functional Sperm.
(2013/03/12) - 糖尿病薬剤による抗腫瘍効果
(2013/03/12) - 難病ALSの新たな原因遺伝子の発見
(2013/03/12) - 脊髄損傷にヒートショックプロテインが有効?
(2013/03/11) - 片頭痛患者では血管内皮前駆細胞が少ない?
(2013/03/11) - 筋幹細胞の静止状態はmiRNA-489により維持される
(2013/03/11) - ストレスに弱いってどういうこと?(心の病気にかかるメカニズムの一つ、「ストレス脆弱モデル」をネズミで再現)
(2013/03/09) - 核酸医薬は実現するか~筋強直性ジストロフィー治療の可能性~
(2013/03/09) - なくならないのは技がある!
(2013/03/08) - Down症候群のiPS細胞の染色体数を修正する
(2013/03/08) - 高品質なiPS細胞作製のキーファクターZscan4の同定
(2013/03/08) - Turning off the Neuron Death Pathway
(2013/03/07) - 新しい安全な分子標識-マルチ同位体画像質量分析法-が明らかにした幹細胞の不等分裂様式
(2013/03/07) - 重度脊髄損傷後に移植した神経幹細胞が非常に長く軸索を伸長し、シナプス結合した!
(2013/03/07) - 神経系前駆細胞を元気にして水頭症を治す!?
(2013/03/05) - FUS/TLSとTDP-43 二つのALS原因遺伝子の交差点
(2013/03/01) - 貪食細胞マクロファージが造血幹細胞を優しく包み込んで自己複製能の維持に貢献していた!?
(2013/02/27) - TALENs -新遺伝子改変技術が生命科学を変える!?-
(2013/02/27) - RESTタンパク質による遺伝子発現調節 ~遺伝子発現とシナプス機能~
(2013/02/25) - 腸に住んでいるある平凡な細菌によって大腸がんは引き起こされる!
(2013/02/25) - 癌抑制遺伝子p53の変異はメバロン酸経路を活性化することで、正常な乳腺の構造を失わせる
(2013/02/25) - 樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛解させる
(2013/02/25) - Schwann Cell Plasticity After Spinal Cord Injury Shown by Neural Crest Lineage Tracing
(2013/02/15) - エクソソームは、癌細胞の「飛び道具」!
(2013/02/08) - 老化したニッチでは筋肉幹細胞は静止状態を保てない
(2013/01/31) - 幹細胞を使った創薬開発
(2013/01/31) - 体細胞リプログラミングにおける遺伝子発現調節の解析からわかること-single cellで見てみようの巻-
(2013/01/31) - がん幹細胞発生のかぎを握るのは誰?-ユーイング肉腫がん幹細胞の解析を通じた検証-
(2013/01/31) - 小動物用PET(Positron Emission Tomography)で、ラットの脳梗塞巣を探知することができる [18F]BMS-PET
(2013/01/31) - 脳の神経ネットワークにおけるヤングパワー!
(2013/01/18) - アストロサイトの性格はどうやって決まる?
(2013/01/18) - 幹細胞の自己複製能を制御する因子とは?
(2013/01/18) - アルデヒドが真犯人!?DNA損傷と再生不良性貧血
(2012/12/18) - HIV-2の新しい定量法
(2012/12/18) - Japanese People's Preference for Place of End-of-Life Care and Death: A Population-Based Nationwide Survey
(2012/12/18) - がん細胞の死に際
(2012/12/18) - 癌幹細胞を眠りから目覚めさせる"Coco"
(2012/12/13) - 細胞接着分子のインテグリンが血液の幹細胞の維持を制御する
(2012/12/11) - 移植された神経幹細胞は免疫系にも作用する
(2012/12/11) - 血液がん克服にむけて!~JAK2阻害剤の薬剤耐性メカニズム解明~
(2012/12/04) - 癌進展を陰で操る支配者
(2012/11/30) - 幹細胞の2つの顔を暴け!!! 未分化性維持と特異的分化との狭間で...
(2012/11/30) - 脊髄損傷後の機能回復には自発的なリハビリが効果的
(2012/11/21) - もしあなたの歯が無くなってしまった時に...
(2012/11/15) - iPS細胞から血小板をつくる
(2012/10/30) - メラノーマのエキソソームで予後予測ができる?!
(2012/10/30) - Oligodendroglia Cells Can Do Much More Than an Insulator for Neuron
(2012/09/11) - APJは、心臓肥大のデュアル受容体として作用する
(2012/09/11) - 幹細胞医療;脳梗塞治療への挑戦
(2012/09/11) - 造血幹細胞の老化と若返り
(2012/09/11) - カロリー制限が筋肉を増やす? - トレーニング界の常識に挑戦する新たな"逆説"
(2012/09/11) - 癌幹細胞は治療標的にならない!?
(2012/08/24) - iPS細胞でC型肝炎ウイルス感染のモデルをつくる
(2012/08/09) - ES細胞、iPS細胞から内耳有毛細胞への分化誘導
(2012/08/09) - 造血幹細胞を冬眠させる細胞はなんと神経系の細胞だった!
(2012/07/06) - 個別化治療への障壁 ~多重人格なガンを克服せよ~
(2012/07/06) - 栄養のバランスが新しいニューロンを作り、体重や新陳代謝をコントロールする
(2012/05/11) - 脊髄不全損傷後におこる、残存神経ネットワークの代償機能
(2012/05/11) - "スーパーPTENマウス"
(2012/04/20) - 統合失調症iPS細胞研究が臨床研究になるために
(2012/04/20) - 発癌機序における"はじめの一歩"
(2012/04/06) - iPS細胞は脊髄損傷を治せるのか?
(2012/04/06)
- 大脳皮質の進化の謎に迫る
- 2011年度
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛...
樹状細胞は制御性T細胞の恒常性をコントロールすることで多発性硬化症を寛解させる
論文紹介著者

柏木 一公(博士課程 1年)
GCOE RA
微生物学免疫学教室(吉村研究室)
第一著者名・掲載雑誌・号・掲載年月
Nir Yogev/Immunity Volume 37, Issue 2, 24 August 2012, Pages 264-275
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Yogev N, Frommer F, Lukas D, Kautz-Neu K, Karram K, Ielo D, von Stebut E, Probst HC, van den Broek M, Riethmacher D, Birnberg T, Blank T, Reizis B, Korn T, Wiendl H, Jung S, Prinz M, Kurschus FC, Waisman A. Dendritic cells ameliorate autoimmunity in the CNS by controlling the homeostasis of PD-1 receptor(+) regulatory T cells. Immunity Volume 37, Issue 2, 24 August 2012, Pages 264-275
論文解説
今回ご紹介する論文は、当GCOEの『炎症・免疫制御と組織再生』サブグループの目的に沿って選びました。私自身が基礎の研究に携わっているため、今回ご紹介する内容はかなり基礎に偏ったものとなっております。難しい内容だとは思いますが、1つずつ内容を噛み砕くように読んでいただければ幸いです。
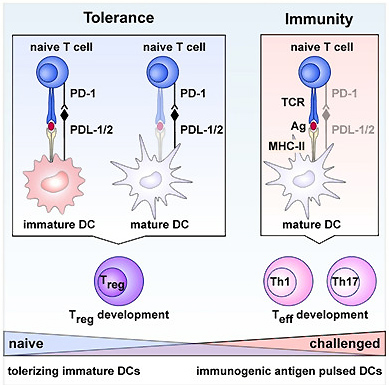
まずお話を始める前に知っておいていただきたい知識として、MHC class II分子のプロセッシング機構というものがあります。体の中の免疫細胞には、侵入してきた細菌やウイルスなど外敵をいち早く発見し、それを取り込んでMHC class II分子に乗せて提示することでT細胞などの攻撃部隊に指令を下す「抗原提示細胞」と呼ばれる細胞たちがいます。その1つであり強力な抗原提示細胞である「樹状細胞」と呼ばれる細胞が今回の主役です。
下の図は『Cellular and Molecular IMMUNOLOGY 7th ed.』という教科書から引用したものです。左側から外敵を取り込んだ抗原提示細胞の中で、外敵のタンパク質がどのようにT細胞(ここではCD4陽性ヘルパーT細胞)に伝えられるかを示した図です。筆者たちはここのCLIPというタンパク質にMOG35-55ペプチドを埋め込んだトランスジェニックマウスを作成することで、恒常的にMOGペプチドがマウスの体の中で抗原提示された状態を作り出しました。
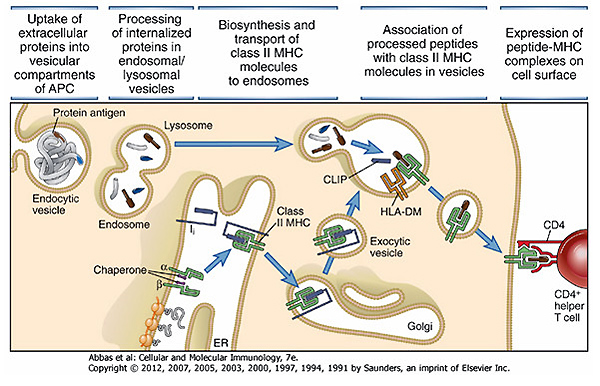
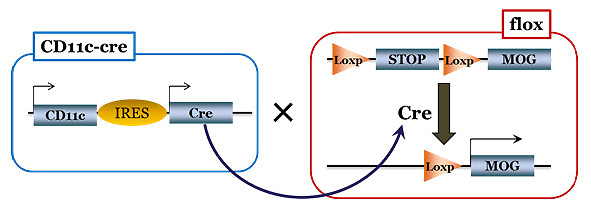
MOG35-55ペプチドというのは神経の髄鞘であるミエリンタンパクを模したペプチドです。このペプチドはマウスに皮下注射することで、自らのミエリンに対する免疫反応が起こってしまい免疫細胞たちが自分の神経細胞を攻撃してしまいます。その結果神経麻痺が起こるという、EAEと呼ばれるマウスの疾患モデルの1つです。これはヒトで言うところの多発性硬化症に類似したものとされており、その研究に利用される手法です。筆者らの作成したトランスジェニックマウスは、このMOGペプチドを恒常的に体の中で作るように設計されたものです。しかしそのままだと常にMOGペプチドを作り続けてしまうため、筆者らはマウスの遺伝子にひと工夫かませています。
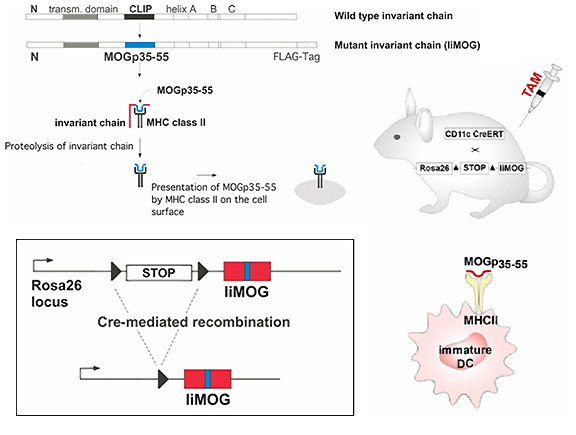
上の図のように、CLIPタンパクの部位に組み込まれたMOGペプチドの前にSTOPコドンを含んだカセットを挿入しています。そうすることでMOGペプチドの前にタンパクの翻訳がストップするようになっているのです。しかしこれではMOGの前で常に翻訳がストップしてしまうため、このSTOPカセットをLoxp配列(▼印)というもので挟み込んでいます。これはCre-loxpシステム (※1)を用いてCD11c分子の下流で消失するように設計されているのです。CD11cというのは樹状細胞で特異的に発現している分子なので、結果的に「樹状細胞で特異的にMOGペプチドがMHC class II分子に乗るマウス」というものが生まれます。
さらにもう1つの工夫がこのマウスにはなされており、CD11cの発現に応じて翻訳されるCre-リコンビナーゼにエストロゲン受容体であるERTを直結させています。これによってエストロゲン受容体に伴って発現しているCre-リコンビナーゼはエストロゲンの類似体であるタモキシフェン (TAM)に反応して細胞の核内へ移行するため、そこで初めて作用することができるようになります。すなわち、「タモキシフェンを注射することで、樹状細胞で特異的にMOGペプチドがMHC class II分子に乗るマウス」というわけです。ものすごくややこしいですが、これが基礎の研究に使われる有名な手法をふんだんに使った実験です。
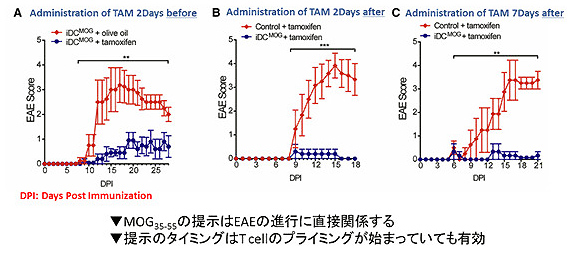
このようにして作成したマウスに対して、先に触れたMOG35-55ペプチドを皮下注射するというマウスの多発性硬化症モデルを起こすという実験を行なったところ、タモキシフェンを注射するとマウス体内での神経細胞への炎症反応が起こりにくいということが分かりました。さらにすごいことに、このタモキシフェンの投与の時期をMOG35-55ペプチドの投与の2日前、2日後、さらに7日後にずらすと7日後に抗原提示させた場合でも炎症反応が抑制されることが分かりました。すなわち、樹状細胞による抗原提示が症状を改善するということも分かったのです。何故このような炎症反応が抑制されるのか、それはこれらの反応に関与しているのが制御性T細胞 (※2)と呼ばれる免疫抑制に働くT細胞で、樹状細胞はこのT細胞の働きを制御することで炎症反応をコントロールしているのです。
さらにもう少し細かい分子のお話をすると、この制御性T細胞の誘導にはPD-1 (※3)と呼ばれるT細胞上の分子と、樹状細胞上に発現しているPDリガンドの (PDL-1/2)のが出会うというシグナルが必要であるということを、筆者たちは明らかにしています。
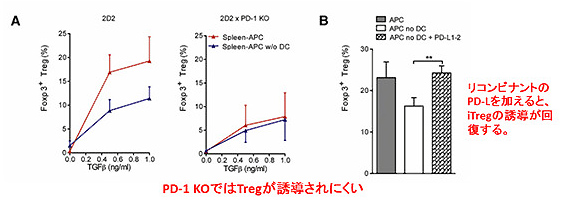
ここまでのお話をまとめると、PD-1とPDリガンドのシグナルによって誘導される制御性T細胞がマウスの多発性硬化症モデルであるEAEを軽減させるということです。このように基礎の研究ではマウスの遺伝子レベルで様々な工夫を加え、目的の実験に即したマウスを作成して実験しています。ここでは紹介しませんでしたが、本論文では他にDTR (※4)と呼ばれるジフテリア毒素受容体を用いた選択的な樹状細胞の欠損マウスを使った実験も行なっています。ここまでの知識があればこの論文は全て読むことができるので、興味を持たれた方は一度読んでみていただけると幸いです。
用語解説
- ※1 Cre-loxpシステム:
条件的遺伝子ノックアウトに用いられる部位特異的組み換え反応を用いたシステムです。Loxpという特定の配列を標的としたDNA組換え酵素であるCre-recombinaseを目的の遺伝子の下流にノックインすることで、その遺伝子を発現する細胞で特異的にノックアウトを行う手法が取られています。今回は樹状細胞に特異的に発現しているCD11cの下流にCreを組み込み、樹状細胞で特異的にSTOPカセットが消失するように設計されたマウスを用いています。
- ※2 制御性T細胞:
CD4陽性のヘルパーT細胞のうち、Foxp3と呼ばれる遺伝子をマスターレギュレータとしてもつ細胞を指します。主に炎症抑制性のサイトカインであるインターロイキン10 (IL-10)を分泌することで炎症を負に制御するという重要な役割を持ちます。制御性T細胞とは英語でRegulatory T cellで、Treg (ティーレグ)と略して読んでいます。 - ※3 PD-1:
PD-1(Programmed cell death 1)は、T細胞の細胞死誘導時に発現する遺伝子として同定されましたが、免疫学ではさらに免疫反応を負に制御するシグナルに関与することが知られています。 - ※4 DTR:
マウスは通常持たない、ヒトのジフテリア毒素受容体 (DiphtheriaToxin Receptor; DTR)を選択的に細胞に発現させることで、ジフテリア毒素をマウスに投与するとDTRを発現している細胞のみがジフテリア毒素によって死滅して体内からなくなるという手法です。例えばマウスの体内から樹状細胞のみをなくしたいときには、CD11cの下流でDTRが発現するように遺伝子をノックインし、ジフテリア毒素をマウスに注射します。すると通常ならば受容体を持たないため作用しないジフテリア毒素が、DTRを発現している樹状細胞でのみ作用するので、マウスの体内から樹状細胞がいなくなるというしくみです。
Copyright © Keio University. All rights reserved.
