- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 体細胞の再プログラム化を阻む"小さなRNA: miR-34&...
体細胞の再プログラム化を阻む"小さなRNA: miR-34"
論文紹介著者

馬場 庸平(博士課程 1年)
GCOE RA
生理学教室
第一著者名・掲載雑誌・号・掲載年月
Yong Jin Choi/Nature Cell Biology published online 23 October 2011
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
miR-34 miRNAs provide a barrier for somatic cell reprogramming.
Choi YJ, Lin CP, Ho JJ, He X, Okada N, Bu P, Zhong Y, Kim SY, Bennett MJ, Chen C, Ozturk A, Hicks GG, Hannon GJ, He L.
Nat Cell Biol. 2011 Oct 23;13(11):1353-60.
論文解説
体細胞の再プログラム化のバリア "小さなRNA: miR-34"
Yong Jin Cho et.al
Nature Cell Biology published online 23 October 2011
体細胞を人工多能性幹細胞(iPS細胞)へと分化した細胞の情報をリセットする"再プログラム"の過程は非常に低い効率でしかおこらない。しかしながら、この効率は癌抑制遺伝子であるp53を欠損させるによって高まることが知られている。
p53がどのようにして体細胞の"再プログラム"を阻むのかについては謎が多く、人工多能性幹細胞(iPS細胞)を効率よく樹立する方法につなげるため多くの研究がなされている。これまでにp53により発現が誘導されるp21が体細胞の再プログラム化を阻むことが明らかとなっているが、その役割はp53のもつ働きの一部に限られ、p53の再プログラム化阻害作用をすべて説明することはできなかった。今回、Yongらは、p53の標的である小さなRNA"miR-34" に着目した。
- Mir34a欠損マウス由来胚性線維芽細胞では再プログラム化が促進される
miR34には、染色体上の異なる領域にMir34a, Mir34b/cの3つがあるが、そのいずれもがマウス胚性線維芽細胞の再プログラム化に伴い誘導されてくる。なかでも発現量の多いMir34aにまず着目し、この遺伝子を欠損したマウスを作成した。このマウスに由来する体細胞である胚性線維芽細胞はMir34aを欠損しており、この細胞にOct3/4, Klf4, Sox2, c-Mycの4因子またはOct3/4, Klf4, Sox2の3因子を導入し再プログラム化させると、その効率はMir34aを欠損していない野生型に比べて4-4.5倍に上昇した。しかも野生型の細胞ではiPS細胞様コロニーの出現に7日かかった、一方で、miR34欠損細胞では5日で出現が認められ、再プログラム化を早められたことも考えられた。 - p21, miR34はp53の下流で協力して体細胞の再プログラム化を制御している。
miR34aと類似する配列を有するmiR34 b/cもiPS細胞の誘導に関わっている可能性が考え、彼らはMir34 b/cを欠損するマウスを作成した。Mir34 b/cのみを欠損する胚性線維芽細胞は再プログラム化が促進されたがその程度はMir 34 a欠損細胞に比べて低かった。しかしながら、これら三種類のMir34すべてを欠損する細胞を作成し、同様の実験を行うと、Mir34a単独の欠損に比べてさらに約1.5倍程度効率が改善した。
これまでにp53の下流で体細胞の再プログラム化を阻むことが知られていたp21も合わせて欠損させた胚性線維芽細胞を用いると、p53の欠損細胞により近い効率になり、miR34とp21は、協力してp53の作用の重要な部分を占めると考えられた。 - Mir34a欠損iPS細胞は野生型iPS細胞と同様の特性を持つ。
Mir34aを欠損する胚性線維芽細胞より樹立されたiPS細胞は、自己複製能・多分化能を持つことも確認された。p53を欠損したiPS細胞は継代とともに胚性幹細胞様の形態を失い、奇形腫への分化がおこりにくくなるなど、自己複製能・多分化能が低下した。一方で、Mir34aを欠損したiPS細胞は安定して継代可能であり、野生型のiPS細胞と同等であった。さらにキメラマウスを作成すると、p53欠損iPS細胞ではキメラ率も非常に低く、しかも多くが腫瘍の発生により死亡したが、miR34a欠損iPS細胞のキメラ率は高く、腫瘍発生も認めていない。 - Nanog, Sox2, N-MycがmiR34aのターゲットである
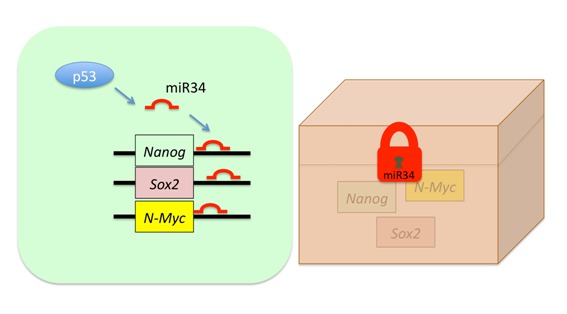
miR34aの再プログラム化における分子機序を解明するため、彼らはmiR34aの結合する遺伝子の検索を行い、多能性遺伝子であるNanog, Sox2, N-Mycの3'UTRに結合部位が予測された。実際、miR34a, miR34b, miR34cを胚性幹細胞に強制発現させると、mRNAの量は変化しないが、これらのタンパク質の量が減少し、またMir34a Mir34b/cを欠損するiPS細胞ではこれらタンパク質の量が増加する。すなわち、Mir34欠損細胞では、複数の多能性遺伝子の転写後抑制が外れていることにより(多能性遺伝子の鍵が外れて)、内在性の多能性遺伝子の回路の成立が促進され、再プログラム化の効率が高まると考えられた。
またMir34欠損iPS細胞は、LIFの除去・レチノイン酸の添加などにより分化を開始させると、形態的な変化も、多能性遺伝子の発現の低下も遅くなり、分化しにくくなっていた。Mir34欠損iPS細胞では自己複製を維持する多能性遺伝子の回路が強固となっている可能性可能性が考えられた。 - 結論
これらのことから、p53の下流では、小さなRNA "miR-34"が、p21などとともに協力して、体細胞の再プログラム化を阻んでいることが明らかとなった。今後、人工多能性幹細胞をより効率よく作る上で、miRNAを操作するというアプローチも重要になろうと思われる。
用語解説
- ※1 miRNA
small non-coding RNAといわれるRNAの一つであり、それ自身はタンパク質に翻訳されない。タンパク質の設計図となるメッセンジャーRNAに結合することにより遺伝子の発現を抑制する働きがある。 - ※2 p53, p21
p53は癌抑制遺伝子として知られ、通常はDNAの損傷など癌化につながるストレスで活性化され、p21の発現を誘導し、細胞周期を止めDNAの修復を促す、また前癌状態の細胞を細胞死により排除するなど多面的な働きにより、癌の発生を抑える働きをする。詳細な機序は分かっていないが、iPS細胞への再プログラムを阻む作用もあり、p53やp53により誘導されるp21を抑制することでiPS作成の効率が良くなることが近年明らかとなっている。
Copyright © Keio University. All rights reserved.
