- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 新たに判明 がんの転移を促進するメカニズム
新たに判明 がんの転移を促進するメカニズム
論文紹介著者

岩井 さやか(博士課程 1年)
GCOE RA
整形外科学、先端医科学研究所 遺伝子制御部門
第一著者名・掲載雑誌・号・掲載年月
Myriam Labelle/Cancer Cell 20, 576-590, November 15, 2011
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Labelle M, Begum S, Hynes RO. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis. Cancer Cell. 20(5):576-90 2011;
論文解説
胎生期の個体を構成する細胞が、その形態学的特徴によって大きく2種類に分けられるということは、19世紀末から知られていました。
主にからだの表面(皮膚や内臓の表面など)を構成する上皮細胞(epithelial cells)と骨・筋肉や血液などを構成する間葉細胞(mesenchymal cells)です。上皮細胞は、整然と配列され、互いに密な連結を有するのに対し、間葉細胞は、細胞外基質の中で、周囲との結合にしばられずに存在しており、運動能を有するのが特徴です。そして、興味深いことに、間葉細胞の素は、胎生期の初期段階で、上皮細胞から「のれん分け」されるように作られます。
このように、上皮(epithelium)の性質を失って、間葉(mesenchyme)としての性質を新たに得る変遷(transit)のメカニズムを、上皮間葉転換(epithelial-mesenchymal transition、EMT)とよび、1980年代初頭に成立した概念です。
上皮の悪性腫瘍であるがんは、局所の制御不能な細胞増殖にはじまり、やがて腫瘍細胞が周囲の構造を壊しながら、血管やリンパ管に侵入し、血液やリンパの還流に乗って他部位に到着、その後、血管・リンパ管外に出て組織に定住することで、遠隔臓器に転移します(図1)。その過程(斜体)において、腫瘍細胞が自身の上皮としての性格を失い、運動能を得るとともに浸潤に有利な特性を有するように、細胞の性質が変化していることがわかりました。つまり、腫瘍細胞は、胎生期のEMTと同様のメカニズムにより間質細胞としての特性を得て、基底膜や管腔の内皮といったバリアをかいくぐりながら、他臓器を侵略していくのです。
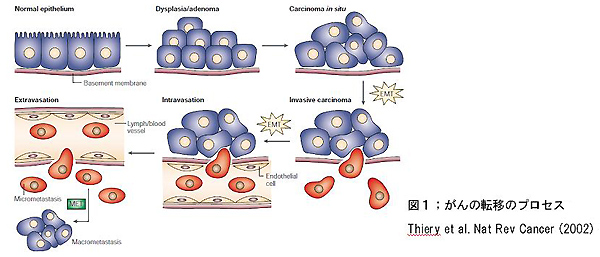
さらに、腫瘍細胞のEMTにおいては、細胞形態の変化や運動能の獲得だけでなく、浸潤・転移により有利となる(=悪性度が増す)ような遺伝子発現パターンの変化も重要な役割を果たします。
がんにおけるEMTの機構が解明され、治療の標的となり得るならば、抗がん剤治療・分子標的薬・外科治療など、原発巣の治療が進歩した現在においても治癒が難しいとされる、治療後の再発や、生命維持にかかわる臓器への転移に苦しむ患者さんが救われる大きな一歩となり、現在盛んに研究が行われている分野です。
今回紹介する論文は、このEMTの機構と転移のプロセスについて、新たな知見を私たちに提供してくれるものです。
がんがその悪性度を維持(時に増)しながら浸潤・転移していくには、腫瘍細胞自身が持つ性質(内的因子)だけでなく、がんの周囲に存在する間質細胞などの細胞のはたらきや、それらから分泌される成長因子やサイトカインによる刺激(微小環境因子)の存在が重要であり、EMTについても同じことがいえます。これまでの研究からは、原発巣におけるhepatocyte growth factor(HGF), fibroblast growth factor(FGF), insulin-like growth factor(IGF)などの成長因子による刺激がEMTを誘発するきっかけであることがわかっていました。これらの外的刺激やEMTは原発巣内で起こる、転移のプロセスをスタートするための準備段階とされていましたが、間質細胞や成長因子・サイトカインの関与が重要なのであれば、それらに富む血流内でも同様のことが起こっている可能性があるとして、本研究がスタートしました。
血流内には、腫瘍細胞に刺激を与え得る分子が数多く存在しますが、その中で、本研究では、EMTを促進し腫瘍の浸潤能を高めることが知られているtransforming growth factor-beta(TGF-beta)に着目しました。この分子について、がんの骨転移では、骨を破壊する破骨細胞が活性化されTGF-betaが放出されることで、腫瘍細胞自身の悪性度が増して転移に有利にはたらく、といったような報告があるものの、肺転移など骨以外の臓器へ転移する場合にTGF-betaがどこから供給されるのかは不明でした。
血液を凝固させるために必要な成分として有名な血小板は、腫瘍との関連では、転移先の臓器への細胞接着を促進し、また、血流内で腫瘍細胞の周囲を固めて免疫細胞の攻撃や血流による物理的ストレスから保護することで、がんの転移を促進するとされてきました。しかし同時に、血小板は成長因子やサイトカインの宝庫であり、前述のTGF-betaにも富むことから、血流のなかで血小板が腫瘍細胞にはたらきかけて、転移に有利な変化を起こしているのではないか、との仮説のもと、大腸がんおよび乳がんの細胞を用いた検討が行われました。
<結果>
- 血小板とともに培養した腫瘍細胞をマウスに移植すると、対照群に比して肺転移が増加した(図2)。
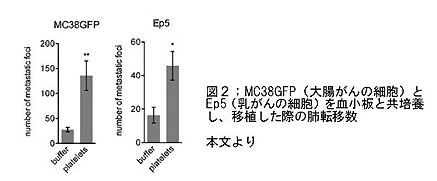
- 血小板とともに培養した腫瘍細胞は、細胞形態・浸潤能・タンパク質の発現パターンともに、EMT様の形態変化を呈した。(図3)。
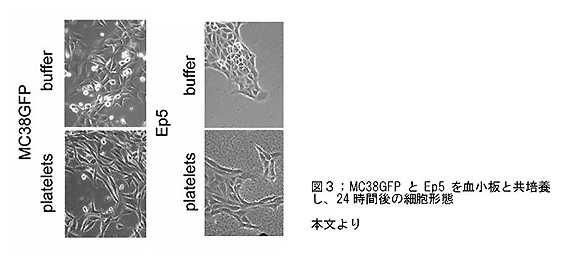
- 血小板からの刺激により、EMT関連の遺伝子、特にTGF-betaによって誘導されるものの発現が上昇していた。
- 血小板から分離したTGF-betaを腫瘍細胞に添加すると、TGF-betaの刺激によって動く細胞内伝達経路(TGF-Smad)が活性化した。
- 血小板とともに培養した細胞を、血小板と巨核球でのみTGF-betaを欠損するマウスに移植し、転移の様子を経時的に追跡すると、腫瘍細胞が血管外に遊出する段階において、対照群と最も大きな差がみられた。
- 血小板と巨核球でTGF-betaを欠損するマウス(=血流内で血小板由来のTGF-betaに接触することが出来ない)に、あらかじめ正常な血小板と接触させておいた腫瘍細胞を移植すると、正常機能血小板のマウスに腫瘍細胞を移植した場合(=血管内に血小板由来のTGF-betaが存在)に比して、転移が抑制された。
- 血小板を、活性化型の血小板から放出される成分(TGF-betaも含む)とそれ以外の成分(ペレット)に分離し、それぞれを腫瘍細胞とともに培養したところ、後者でも転移が促進されていた。
- ペレットと腫瘍細胞を接触させた場合の細胞内伝達経路を解析すると、TGF-Smadの活性化は伴わずに、nuclear factor kappa-light-chain-enhancer of activated B cells(NF-κB)の経路が活性化することで転移が促進されていた(図4)。
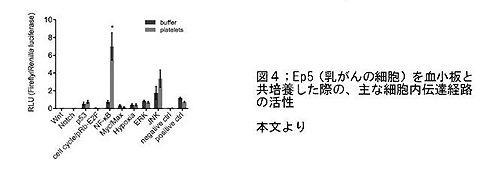
これらの結果から、血小板は、今まで知られていたよりももっと積極的な方法で、腫瘍の進展に寄与していることがわかりました。
腫瘍細胞は原発巣で転移に向かう指令を受ける、というのがこれまでの概念でしたが、今回の研究からは、原発巣を出て転移巣に向かうその道中で、血小板と接触することにより、腫瘍細胞はEMTさながらに自身の性質を変えることができ、結果的に転移が促進される、という新たな事実が判明しました。これは同時に、何らかの理由で原発巣でのEMTを介さずに血流内に侵入し得た腫瘍細胞も、そこで受ける外的刺激によってEMT様の変化が誘導され、浸潤・転移に有利な特性を新たに獲得することが出来る可能性を示唆します。
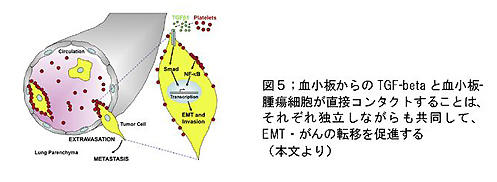
血流内では、血小板からの刺激によって、腫瘍細胞のふたつの細胞内伝達経路が活性化していました。血小板から分泌されるTGF-betaにはじまるTGF-Smad の経路、もうひとつは、血小板そのものと腫瘍細胞が直接コンタクトすることによって活性化するNFκBの経路です。これらの経路は互いに独立した機構によって活性化されますが、協同して腫瘍細胞のEMT様変化を促進し、浸潤・転移の過程の中でも特に、転移する臓器において血管内から血管外へ腫瘍細胞が遊出するプロセスで有利に働くことがわかりました(図5)。
がんを学問としてとらえてこの論文を読むと、本研究は、これまで知られていたがんの転移におけるEMTの役割について一石を投じるものであり、がんと微小環境の関係にも新たな視点を供与する、非常に興味深い内容です。
さらに重要なことは、がんの初期段階で転移を予防する、治療中のがんがさらに他臓器に進展していくことを防ぐなど、実際に新たな治療戦略を考えていくなかで、ここで明らかにされた機構が、治療のターゲットの一候補となり得る可能性を秘めているということです。筆者は、血小板由来のTGF-betaを阻害することを例として挙げており、今後の発展が待たれるところです。
最後に、この研究と幹細胞医学との関連について加筆します。
血小板による刺激をEMT様変化へと結びつける役割を果たすことが判明したNFκB経路は、炎症反応・免疫反応をはじめ、数多くの生理現象で活躍するメジャープレーヤーですが、最近では、がん幹細胞(cancer stem cells, CSCs)の維持という役割についても注目されるようになってきました。
正常組織において、幹細胞が自ら複製・増殖し、必要な種類の細胞に分化していくことで、その組織が保たれるのと同じように、がんにも「幹細胞」の役割を果たす少数の細胞群が存在するというモデルが提唱されており、その細胞群をがん幹細胞とよびます。がん幹細胞はストレスに強い特性を持つので、抗がん剤などの治療後にも残存し、自分自身を元にがん細胞を新たに生み出すことで、治療前と同じようながんの組織を築くと考えられており、治療後の再発などに関与するとして注目されている機構です。正常の幹細胞同様、がん幹細胞の維持にも、前半で述べたような微小環境因子が重要ですが、微小環境から提供されるサイトカインが、がん細胞や間質細胞のNFκB経路を活性化し、それらからの更なるサイトカイン産生が促され...と、サイトカインとNFκBを介した正のフィードバックがかかっていくことによって、がん幹細胞の自己複製能が維持されることがわかっています。
そこで、この研究で明らかとなった、血小板によって活性化される腫瘍細胞内のNFκB経路が、がん細胞のEMT様変化を惹起するだけでなく、がん幹細胞の維持にも同時に関わるという可能性は考えられないでしょうか。もしも今後の研究によってその点が明らかとなれば、血小板と腫瘍細胞との接触によってもたらされる細胞内の一連の動きをブロックすることで、EMTを抑制するのみでなく、治療抵抗性や再発を陰で操るがん幹細胞をもコントロールでき、複数のメカニズムからがんの転移を予防し得る、新たな道がみえてきます。
Copyright © Keio University. All rights reserved.
