- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 癌幹細胞を制御するHippo pathway
癌幹細胞を制御するHippo pathway
論文紹介著者

千代田 達幸(博士課程 3年)
GCOE RA
産婦人科 先端医科学研究所遺伝子制御部門
第一著者名・掲載雑誌・号・掲載年月
Michelangelo Cordenonsi/Cell. 2011 Nov 11;147(4):759-72.
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Michelangelo Cordenonsi, Francesca Zanconato, Luca Azzolin, Mattia Forcato, Antonio Rosato, Chiara Frasson, Masafumi Inui, Marco Montagner, Anna R. Parenti, Alessandro Poletti, Maria Grazia Daidone, Sirio Dupont, Giuseppe Basso, Silvio Bicciato, and Stefano Piccolo, The Hippo transducer TAZ confers cancer stem cell-related traits on breast cancer cells. Cell. 2011 Nov 11;147(4):759-72.
論文解説
はじめに
あらゆる組織には幹細胞が存在し、組織の再構築や再生に関わることが知られています。癌においても、自己複製能をもち、腫瘍形成能をもつ癌幹細胞(cancer stem cells: CSCs)が存在するという概念が近年提唱されてきました。現在、in vitroにおいて自己複製能をもち、in vivoにおいて癌を形成できる細胞をCSCと呼んでいますが、細胞をCSCたらしめるメカニズムについてはよくわかっていません。
乳癌においては上皮間葉転換(epithelial to mesenchymal transition: EMT)がCSC様の性質獲得に重要であることが知られています。実際の癌の病理所見においてEMTが観察されることは稀という意見もありますが、細胞極性の消失もEMTの一部と考えるならば、それは癌における主要な所見といえます。
今回の論文では、EMTがCSCに関わるメカニズムとしてHippo pathwayの存在が明らかになりましたので、ご紹介したいと思います。
Hippo pathwayとは?
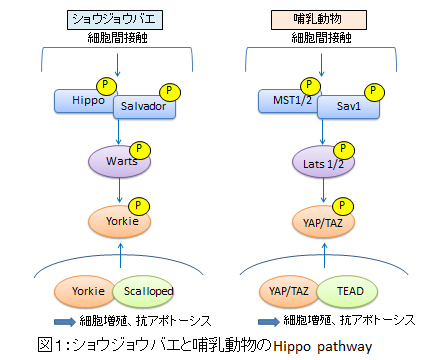
我々の個々の器官は、固有のサイズと構築パターンをもちます。器官が正しく形成され、維持されるためには細胞の大きさと数を制御する仕組みが必要です。1990年代にショウジョウバエのモザイク解析法によりその仕組みを分子レベルで解析する試みが行われ、Hippo, Sav (Salvador), Wts (Warts)からなるHippo pathwayが発見されました。Hippo pathwayに機能不全がおきると細胞増殖促進と細胞死への抵抗性を示し、Hippo pathwayはcontact inhibitionを担うシグナル伝達系として働き、器官サイズを保つと理解されます。Hippo pathwayが活性化するとWtsがYorkieをリン酸化し、Yorkieは核内から細胞質に移行します(図1)。Yorkieは細胞周期促進、細胞死抑制に働く遺伝子の転写を活性化しているため、Yorkieの核外移行は細胞周期阻止、細胞死誘導の方向に働きます。これらの経路は概ね哺乳動物でも保存されていることがわかってきました(図1)。
では今回の論文の内容に入っていきます。低分化な乳癌は高分化型の乳癌に比べてCSCの割合が多いということが知られています。筆者らはまず、低分化型G3と 高分化型G1の乳癌のgene signatureを比較しました。そしてERBB2, RAS, Notch, TGF-β, Wnt/β-catenin, Src, STAT3, NF-κB, Hippoの各シグナル伝達系のsignatureとの関わりを検索したところ、G3乳癌に特徴的なのはHippo pathwayのtransducerであるTAZとYAPの発現でした。既知のデータセットを用いた解析では、TAZ/YAPの高発現が認められる乳癌は転移が高頻度にみられ、予後が悪いということがわかりました。
乳癌の細胞株MCF-10AをRasで形質転換させたMII株とそこから派生した悪性度の高いMIV株を比較したところ、MIV株にはYAPではなくTAZの高発現が特徴的であることがわかりました。MIV株でTAZをノックダウンしたところマンモスフェアの形成は抑制され、また、マウスへの腫瘍形成も抑制されました。これから、TAZは自己複製能と腫瘍形成能に必要であることがわかりました。
乳癌においてCD44high/CD24lowがCSCのマーカーとして知られています。CD44high/CD24low分画ではTAZの発現が高く、TAZをノックダウンするとCD44high/CD24low細胞の割合が減少し、自己複製能も抑制されることがわかりました。また、活性型TAZ (S89A)をMII株に強制発現することによりCD44high/CD24low分画が増加し、自己複製能も亢進することがわかりました。さらに活性型TAZの発現により、化学療法への抵抗性も上昇し、より低分化な癌を形成することがわかりました。これらの結果から、TAZは分化した細胞にCSC様の性質を獲得させることができることが示されました。
ではTAZとEMTとの関係はどうなっているのでしょうか?TAZがEMTをおこすのか、それともEMTの下流にTAZが存在するのでしょうか?TAZノックダウンにより、E-カドヘリンの発現や細胞形態には変化は認められず、EMTのinducerであるTwistやSnailの発現によりTAZの発現は上昇することがわかりました。よって、EMTの下流にTAZが位置し、EMTはTAZを介して自己複製能を付与していることがわかりました。
Hippo pathwayは複数の異なる細胞外経路からシグナル入力を受けます。Scrib (scribble) /Lgl (lethal giant larvae) /Dlg (disclarge)複合体は上皮組織の基底膜ドメインに局在し、Hippo pathwayを介して増殖を抑制することが知られています。なかでも細胞極性の維持に重要なものがScribbleです。筆者らはEMTとHippo pathwayをつなぐ因子としてScribbleを考えました。MII株においてScribbleをノックダウンしたところ、TAZの発現が上昇しました。EMTを誘導したあとでは、ScribbleノックダウンによるTAZのさらなる発現上昇は認められませんでした。これはEMTによりすでにScribbleの不活性化がおきており、TAZは高発現となっていることを示唆しています。Scribbleの不活性化のメカニズムとしては、EMTによりScribbleの局在が変化していることがわかりました。通常Scribbleは細胞膜に局在していますが、EMTにより細胞質に存在するようになります。また、細胞膜に局在できないScribbleの変異体(P305L)の発現により、TAZの蛋白発現と活性は上昇することがわかりました。これらより、EMTはScribbleを細胞膜から外し、TAZはScribbleによる抑制から解除されることで、細胞はCSC様の性質を獲得するというシナリオが成り立ちます(図2)。実際にScribbleノックダウンによりTAZ, LATS, MSTの複合体は認められなくなり、EMTによって、ScribbleがHippo pathwayを介してTAZを核外に出し分解させているメカニズムが働かなくなることで、CSC様形質を獲得することが示唆されました。
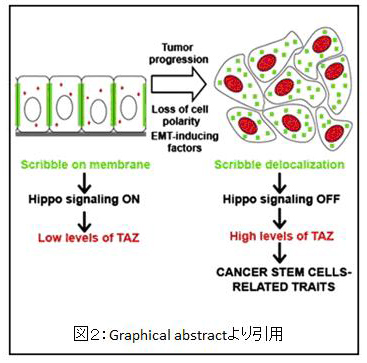
同時期にglioblastomaにおいてもTAZがCSC様性質の獲得に重要であることが報告されました( Bhat KP et al., Genes Dev 2011)。筆者らのグループは機械的な刺激(mechanotransduction)のセンサーとしてYAP/TAZが重要であることも報告しており(Dupont S et al., Nature 2011)、ニッチから受ける機械的刺激やEMTが複雑にCSCを制御していることが示唆されます。今後は治療標的候補としての研究も盛んになるものと思われ、他のシグナル伝達系に比べ遅れてやってきた"Hippo pathway"の今後のさらなる展開が楽しみです。
Copyright © Keio University. All rights reserved.
