- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 意外に他力本願???他者の掘ったトンネルを行く癌細胞
意外に他力本願???他者の掘ったトンネルを行く癌細胞
論文紹介著者

吉田 剛(博士課程 1年)
GCOE RA
先端医科学研究所
遺伝子制御研究部門
第一著者名・掲載雑誌・号・掲載年月
Victoria Sanz-Moreno/Cancer Cell. 2011 Aug 16;20(2):229-45. DOI 10.1016/j.ccr.2011.06.018
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
ROCK and JAK1 Signaling Cooperate to Control Actomyosin Contractility in Tumor Cells and Stroma.
Sanz-Moreno V, Gaggioli C, Yeo M, Albrengues J, Wallberg F, Viros A, Hooper S, Mitter R, Feral CC, Cook M, Larkin J, Marais R, Meneguzzi G, Sahai E, Marshall CJ.
Oncogene Team, Institute of Cancer Research, Section of Cell and Molecular Biology, Cancer Research UK Tumour Cell Signalling Unit, 237 Fulham Road, London SW3 6JB, UK; Randall Division of Cell and Molecular Biophysics, New Hunt's House, Guy's Campus, London SE1UL, UK.
Cancer Cell. 2011 Aug 16;20(2):229-45.
DOI 10.1016/j.ccr.2011.06.018
論文解説
線維芽細胞は多くの固形腫瘍で認められる間質細胞の1つです。癌関連線維芽細胞(cancer-associated fibroblasts; 以下CAFと略記)と呼ばれるこの細胞は、固形腫瘍の血管新生や浸潤・転移を促進することが多数の研究報告で指摘されてきました。電顕形態学的には明瞭な分化傾向は認められず、細胞質内には小胞体が多く観察されます。近年の研究によって、腫瘍細胞の増殖促進に働くさまざまな増殖因子を産生するといった腫瘍組織との相互作用が如何に重要であるかが注目されています。そのため、最近の癌治療開発では癌細胞そのものではなく、癌細胞をとりまくCAFを標的とする治療戦略が積極的に進んでいます。本論文は固形腫瘍のうち皮膚腫瘍の代表である扁平上皮癌(squamous cell carcinoma; 以下SCCと略記)、そしてメラノーマの浸潤におけるCAFの重要性に焦点を当てた興味深い論文です。
癌細胞は浸潤や転移の様式にあたって、個々の細胞がばらばらに運動能を発揮して移動するsingle cell invasion/ metastasisと、複数の癌細胞が集塊を形成して移動するcollective cell invasion/ metastasisに大別することができます。メラノーマは前者の代表例、そしてSCCは後者の代表例です。single cell invasion/ metastasisでは、腫瘍細胞は結合組織を移動する過程で脱分化が進むとE-カドヘリンによる細胞間接着を喪失し、細胞集団を離脱して単独移動できるようになります。対してcollective cell invasion/ metastasisでは、基底膜の破綻というイベントの後に、周囲の上皮細胞と細胞間接着が維持されており、複数の細胞がクラスターとなって、細胞極性を維持しながら、移動します。一般的に扁平上皮癌はcollective cell invasion/ metastasisを呈するという共通項があります。
この研究分野において歴史的に非常に有名な論文内容をまずご紹介しましょう(Gaggioli C, et al. Fibroblast-led collective invasion of carcinoma cells with differing roles for RhoGTPases in leading and following cells. Nat Cell Biol. 2007 Dec;9(12):1392-400.)。その論文では、I型コラーゲンなどの細胞外基質(extracellular matrix; 以下ECMと略記)(注釈※1)を含むゲル上でSCC細胞を培養してもゲルに向かって浸潤しませんが、SCC組織中から分離したCAFとSCC細胞とを共培養すると、途端にSCC細胞は浸潤能を獲得します。興味深いことにその浸潤先端部には常にCAFが存在しており、その後方にはメタロプテアーゼ(matrix metalloproteinase ; 以下MMPと略記) (注釈※2)によって分解されたECMを認めます。SCC細胞に対してMMP阻害剤を投与しても浸潤は抑制されませんが、CAFに対してMMP阻害剤を投与すると浸潤が抑制されることから、「トンネルづくり」はCAFが担っていることが分かります。ただ小さな空間を通るためには細胞の形態を変化させることが必要であり、その際に細胞骨格を制御するRho/ROCKシグナル(注釈※3)が重要となってきます。実際に、CAFに対してRho/ROCKシグナル阻害剤を投与しても浸潤は抑制されませんが、SCC細胞にRho/ROCKシグナル阻害剤を投与すると浸潤は抑制されます。これらの事実から、SCC細胞に先駆けてCAFがトンネルを作り、その空間をSCC細胞が通過することで浸潤が成立することが知られています(図1)。このようにこれまでも、腫瘍細胞が直接的にECMを分解するわけではなく、CAFがMMPによって溶解し再構築したECMの間隙をアメーバのように仮足(pseudopodium)を出しながら進む「アメーバ様運動による浸潤」は病理学的にも重要視されてきました。
注意するべき点は、本論文で注目している浸潤形式は、腫瘍細胞が浸潤転移する際に頻繁に認められる上皮間葉転換(epithelial-msenchymal transition; EMT)に依存しない浸潤様式だということです。これを間葉アメーバ様転換(mesenchymal-amoeboid transition; 以下MATと略記)と呼びます。MATでは、MMPを分泌してECMを分解するCAFといった間葉系運動をする細胞が非常に重要な役割を果たします。
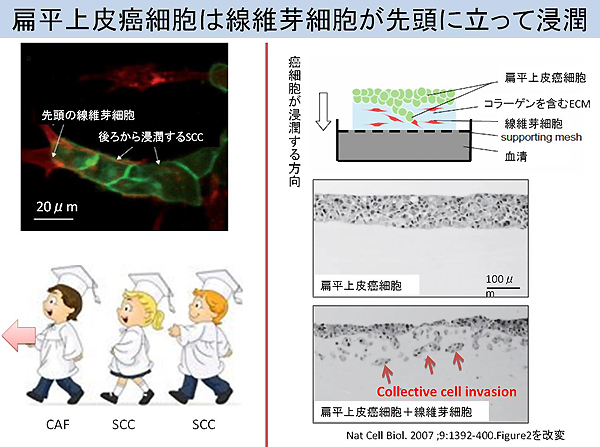
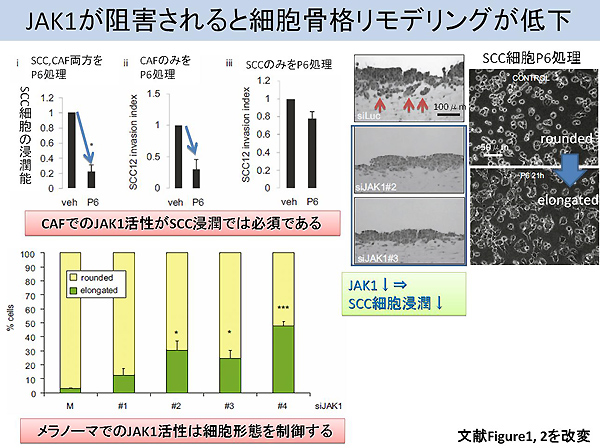
それでは本題の論文に入りましょう。筆者らはJAK/STATシグナル(注釈※4)がCAFを先頭とする腫瘍細胞の浸潤に重要であるという仮説のもと検証を進めています。SCC細胞とCAFにpyridone 6 (以下P6と略記)というJAK阻害剤を投与した際に、細胞収縮力と浸潤能が顕著に低下しました。投与10分後には活性型STAT3が消失し、数時間にわたってその薬剤効果は持続しました。さらに、どのサブタイプのJAKがこの現象に関わっているかを同定するために、一過性に発現低下させたところJAK1が重要であることが判明しました(図2)。JAK1の発現を消失させたところ、細胞骨格制御に重要なミオシン軽鎖の活性型フォームも著減しました。ミオシン軽鎖がリン酸化されると、ミオシンのATPase活性が増加することでアクチンフィラメントの束の収縮が惹起されます。特記すべき点として筆者らは腫瘍細胞の形態をrounded pattern(球形の細胞)とelongated pattern(突起性の細胞質を有する細胞)に分けて解析しています。球形の細胞ではJAK/STAT経路によって活性化されるミオシン軽鎖のリン酸化に伴う細胞骨格リモデリングが活性化しています。SCC細胞でもメラノーマ細胞でも、JAK1発現が消失するとrounded patternからelongated patternへの形態学的シフトが促進されます(図2)。後者は上皮細胞としての極性を喪失しており、自在に細胞の形態を変化させることでCAFが作ったトンネル空間を通過します。言い換えると、rounded patternはアメーバ様運動を呈して極性を維持している一方で、elongated patternでは間葉系細胞への形態変化であり極性が喪失します。興味深いことに全ての腫瘍細胞がelongated patternに変化するわけでないという点です。浸潤にあたっては両者の存在が必須であることが示唆されます。CAFが作ったトンネルを潜って浸潤するために、SCCのcollective cell invasionではrounded patterの細胞が、球形の細胞がメラノーマのsingle cell invasionではelongated patternの細胞がより重要となってきます。
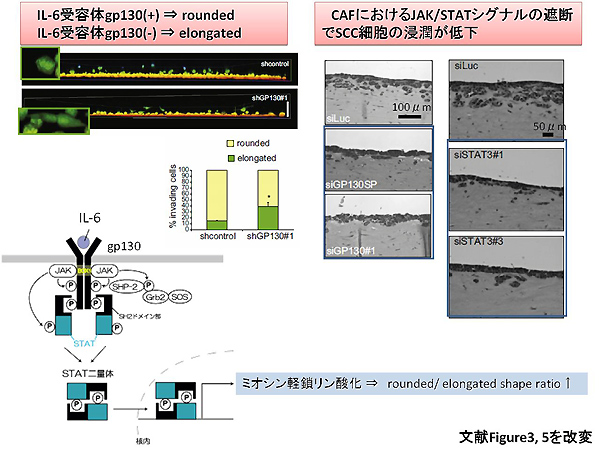
筆者らはIL-6という炎症性サイトカインがCAFの細胞膜上の受容体gp130に結合することでミオシン軽鎖リン酸化が促進されてECMのリモデリングが促進されることを証明しました。腫瘍細胞の形態学的解析では、IL-6受容体であるgp130の欠損やシグナル下流分子であるSTAT3の欠損ではrounded patternを保てなくなり、elongated patternに変化することを証明しています。逆にJAK/STATシグナルのリガンドとしてIL-6以外に有名なオンコスタチンM(注釈※5)投与によるSCC細胞のrounded pattern維持に随伴するcollective cell invasionが認められました。上記と同様の実験系をメラノーマ細胞に施行してもrounded patternは維持される方向に誘導されますが、癌腫の違いからsingle cell invasionを認めました。いずれにせよ、臨床的に広く認められている「血清中のIL-6が高値な担癌患者ほど予後不良である」という公式を分子病理学的に支持する結果が得られたと言えるでしょう。
【Take Home Message】
Rho/ROCKシグナルやJAK/STATシグナルをはじめとする細胞骨格制御を司るCAFでのシグナル伝達によって、腫瘍細胞は上皮間葉転換(epithelial-mesenchymal transition; EMT -注釈※6)を呈さずに浸潤・転移を起こすことができる。
ここからは、本論文の臨床的応用性に関する私自身の考えを述べさせてもらいます。以上の結果から、JAK/STATシグナルを阻害する分子標的薬だけでなく、膠原病リウマチ内科で普及されつつあるIL-6中和抗体トシリズマブ(商品名アクテムラ)も腫瘍の浸潤を抑制する臨床的効果を内在することが期待されます。それだけでなくアクテムラは末期の担癌患者で認められる慢性低栄養、炎症、消耗性の病態である"悪液質(cachexia)"の改善にも効果を示します。但しアクテムラに限らず、シグナル伝達の特定分子を標的とした分子標的薬治療(molecular target therapy)には以下の点で注意が必要です。ですから私たちは、日進月歩する基礎研究を一喜一憂せずに冷静に見ていく必要があります。
- 腫瘍細胞はクロストークする多彩な生存・増殖シグナルが惹起される可能性があります ⇒ 投薬中に不応性・抵抗性を獲得する可能性があります!
- 医療経済的な負担を増加させる可能性があります ⇒ 分子標的薬は薬価が高い上に、根治的な治療戦略ではなく「分子病理学的研究に則った姑息的治療」という弱さがあります!
用語解説
- ※1 ECM
細胞を物質的に支持するだけでなく、成長因子・ホルモン・サイトカインなどの液性因子を介して細胞外の情報を細胞に伝える役割を担っています。成分としては、コラーゲン・エラスチンなどの線維成分とプロテオグリカン・グルコサミノグリカンなどの非線維成分および、これらと細胞との接着を調節するフィブロネクチン・ラミニン・ヒアルロン酸・オステオポンチンなどの接着物質とから構成されます。 - ※2 MMP
MMPは臓器発生、創傷治癒、血管新生、癌細胞の浸潤や転移などのさまざまな生理的および病理的な生命現象に関与するタンパク質分解酵素です。哺乳類では現在までに20種以上のMMPが同定されており、分泌型と膜結合型(MT-MMPs:membrane-type MMPs)に大別されます。前者は亜鉛などの金属イオンを活性化に必要とします。例えばMT1-MMPは、ヒアルロン酸やオステオポンチンをリガンドとする接着分子CD44を介して運動先進部へ運ばれ、自らCD44を切断することで運動性を亢進します。 - ※3 Rho/ROCKシグナル
Rho/ROCKシグナルは細胞骨格を制御することが広く知られています。ROCKとは、活性型Rhoに選択的に結合することで活性化されるセリン・スレオニンキナーゼです。Rho/ROCKシグナルが活性化するとミオシン軽鎖がリン酸化されます。するとアクチンフィラメントの再構築を介して、細胞の形態的な変化や細胞質分裂、細胞間接着能、遊走能などに関与しています(図4)。
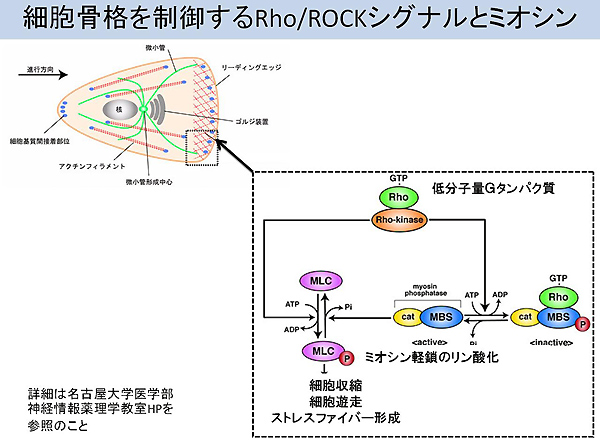
- ※4 JAK/STATシグナル
IL-6に代表されるサイトカインの結合は受容体の二量体化を誘導し、これが会合しているJAKを活性化します。JAKは自己リン酸化と受容体のリン酸化を行い、受容体とJAKのリン酸化部位は、STAT3のようなSH2ドメインを持つSTAT3などを介してシグナル伝達を行います。活性化したSTATはJAKによってリン酸化されるとホモ二量体を形成して核内に移行し、標的遺伝子の転写を調節します。IL-6をリガンドとするJAK/STATシグナル伝達では、STAT3が恒常的に活性化しており、自己免疫疾患、多発性骨髄腫や前立腺癌などで認められています。 - ※5 オンコスタチンM
オンコスタチンM(OSM)は、造血、免疫、代謝など幅広い生体現象において重要な機能を果たす IL-6ファミリーのサイトカインです。具体的には肝障害後の再生に寄与することがよく研究されています。オンコスタチンMをノックアウトしたマウスでは肝臓の線維化が進んでしまったり、肝臓幹細胞からの分化細胞動員が抑制されたりして、肝障害からの再生遷延を呈します。 - ※6 EMT
炎症・低酸素・酸化ストレスなどによってがん細胞での接着分子発現量が低下し細胞外マトリックスとの接着を主体とする間葉系細胞に変化して組織を動的に再構築(リモデリング)する現象を指す。器官や組織の発生段階でのEMTをtype1 EMT、組織修復や線維化でのEMTをtype2 EMTと定義した上で、Kalluri & Weinbergはこのようながん細胞において生じるEMTをtype3 EMTと定義する。
Copyright © Keio University. All rights reserved.
