- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
論文紹介著者

田宮 大雅(博士課程 1年)
GCOE RA
微生物学・免疫学教室
第一著者名・掲載雑誌・号・掲載年月
Yi Liu/Nature medicine, 2011 Nov 20;17(12):1594-601.
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Liu Y, Wang L, Kikuiri T, Akiyama K, Chen C, Xu X, Yang R, Chen W, Wang S, Shi S. Mesenchymal stem cell-based tissue regeneration is governed by recipient T lymphocytes via IFN-γ and TNF-α. Nature medicine. 2011 Nov 20;17(12):1594-601.
論文解説
背景
はじめに幹細胞とは、多分化能と自己複製能を併せ持ち、様々な組織の元となっている細胞です。幹細胞を用いた再生治療は組織の再構築においてその有効性が保証されている手段であるでしょう。骨髄間葉系幹細胞Bone Marrow Mesenchymal stem cells(BMMSC)は、骨をつくる骨芽細胞や軟骨細胞、脂肪細胞など間葉系と非間葉系両方ともに分化する能力を持った細胞です。最近の研究により、BMMSCを体内に移植すると、損傷・疾患の組織に取って代わるために体内の細胞と強調して新しい骨や骨周辺組織の再生を促進することがわかってきました。しかしながら、骨再生能にも限界があり、大きな骨欠損は自然には修復されません。そこでBMMSCと他の細胞との関係を明らかにすることにより、骨再生能を高める方法を見つけ出そうと著者らは考えました。この論文では特に免疫細胞との関係性に焦点を絞っています。
T細胞がBMMSCによる骨再生を抑制する
まず骨再生のモデルとして、人工的にマウスの骨を欠損させ、その欠損部位にBMMSCとハイドロキシアパタイト(HA)ビーズを移植して骨再生の様子をみる方法を用いました。正常マウスでは骨再生はみられませんでしたが、免疫細胞を欠損させたnudeマウスでは確認されました。しかしながらCD4+T細胞を移入させたnudeマウスでは正常マウスと同様に骨再生が確認されなかったことから、CD4+T細胞がBMMSCによる骨再生を抑制していることが考えられました(図1)。CD4+T細胞はヘルパーT細胞とよばれ、種々のサイトカインを産生することによって他の細胞の活性化や機能の行使を助けます。
組織中のサイトカイン濃度を測定したところ、nudeマウスでは変化がなかったのに対し、骨再生の起こらない正常マウスおよびCD4+T細胞移入nudeマウスにおいてTNF-αとIFN-γが上昇していました。そこでnudeマウスにBMMSCとともにTNF-αまたはIFN-γを投与すると骨再生は確認できず、逆にTNF-αおよびIFN-γの中和抗体を投与すると正常マウスにおいても骨が再生されました。したがってTNF-αおよびIFN-γによりBMMSCの骨再生は抑制されることが示唆されました。
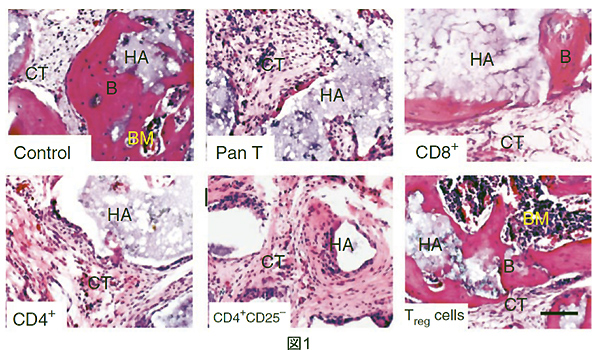
TregはBMMSCによる骨再生を亢進させる
CD4+T細胞にはいくつかの種類が存在しますが、その中の一つregulatory T細胞(Treg) は免疫抑制能を持つ細胞集団です。CD4+T細胞移入nudeマウスでは骨再生がみられませんでしたがTreg移入nudeマウスにおいては確認され(図1)、さらには通常骨再生されない正常マウスにTregを移入したところ、TNF-αやIFN-γの産生を抑え骨再生を促進していました。
TNF-αとIFNγは相乗的に働いてBMMSCに細胞死を誘導する
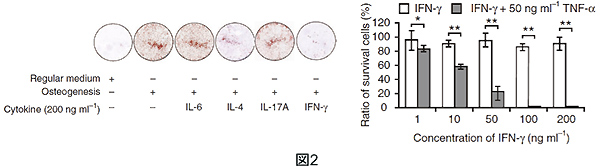
次にTNF-αとIFN-γがどのように働いて骨再生を抑制しているのかを検討するために、in vitroでBMMSCの骨形成を評価しました。無添加時と比較し、IFN-γはBMMSCの骨形成を強く抑制することがわかりました(図2)。さらにTNF-αはBMMSCに細胞死を誘導させ、IFN-γ共存在時ではこの効果が増強されました(図2)。これはIFN-γ刺激によりBMMSCにおいて、骨形成を促進させるSmad6やRunx2、細胞死を誘導するFasなどの分子の発現を上昇させ、細胞死を抑制するTNFR2やXIAPなどの発現を減少させることによるものであることがわかりました。
Tregやアスピリン投与による骨再生能力の向上
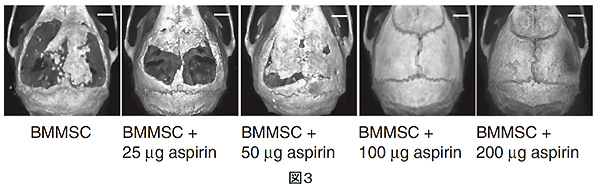
最後に実際に頭蓋骨を欠損させる実験モデルを用いて今回の結果の治療への応用の可能性をみています。無処置時では骨再生はほぼみられなかったのに対し、BMMSC単独移植時では部分的に、BMMSCとTreg移植時では完全に頭蓋骨が再生されていました。また消炎鎮痛剤であるアスピリンはTNF-αやIFN-γの産生を抑制することが知られています。BMMSC移植時にアスピリンを投与した実験ではTreg移入時と同様に完全に頭蓋骨が再生されることを確認しました(図3)。
まとめ
これまでに骨の再生のために体外で増殖させた骨前駆細胞を使った臨床応用は様々なされてきましたが、細胞を用いた組織再構築は身体機能を取り戻させるような大量で高品質な組織をつくり出すまでには未だ至っておりません。この研究では、BMMSCを用いた組織再生はTNF-αとIFN-γ産生を抑制するアスピリンの投与や免疫抑制能を持つTregの移入によって改善されることを示しました。アスピリンは世界で広く用いられている非ステロイド性抗炎症剤であり、Tregは現在精力的に研究がされている分野です。これをさらに応用させることによってヒトにおいても副作用もさほどなくほぼ完全に組織が再生する治療法が開発されることが期待されます。
用語解説
- ※1 ハイドロキシアパタイトビーズ
骨伝導構造として円柱状の貫通孔を有する球状の水酸アパタイトビーズです。生体由来因子が容易に侵入することができ、細胞誘導能が優れているため、細胞の増殖・分化の足場として適しています。良好な骨形成が期待されます。 - ※2 TNF-α
炎症性サイトカインの一つであり、細胞死の誘導や他の炎症性サイトカインの産生亢進を行うことにより感染防御や抗腫瘍作用に関与しています。 - ※3 IFN-γ
活性化されたT細胞で産生され免疫系と炎症反応に対して調節作用を有しています。Th1細胞からも分泌され、白血球を感染局所にリクルートして炎症を強化する作用があります。
Copyright © Keio University. All rights reserved.
