- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 新しいRNA間コミュニケーションのカタチ@筋肉
新しいRNA間コミュニケーションのカタチ@筋肉
論文紹介著者

津山 淳(博士課程 1年)
GCOE RA
生理学教室
第一著者名・掲載雑誌・号・掲載年月
Marcella Cesana/Cell 2011 ;147(2):358-69. Oct 14
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Marcella Cesana, Davide Cacchiarelli, Ivano Legnini, Tiziana Santini, Olga Sthandier, Mauro Chinappi, Anna Tramontano, and Irene Bozzon. A Long Noncoding RNA Controls Muscle Differentiation by Functioning as a Competing Endogenous RNA. Cell. 147(2):358-69.2011
論文解説
背景
タンパク質を作らないRNAに意味はある?
従来、生命の遺伝情報はDNAからmRNAを経てタンパク質となることでその機能を発現するものと考えられており、mRNAをコードしているDNA領域が遺伝子と呼ばれていました。
ところが、ヒトゲノムプロジェクトによって明らかにされたヒトの遺伝子の総数は、研究者達の予想に反して、線虫のような下等生物とほぼ同数という結果でした。ほぼ同数の遺伝子しか持たないにもかかわらず、どのようにして高等生物の複雑性は作り上げられているのでしょうか?
1つの手掛かりとして、ヒトのゲノムは線虫の約30倍大きいことが挙げられます。これはヒトと線虫における大きな差です。ヒトではタンパク質をコードしている領域はゲノムの2%に過ぎず、他の大部分の領域はジャンクDNAと呼ばれており長らくその機能は不明でした。
近年、細胞内RNAの網羅的解析が行われ、ジャンクとされていた領域からも大量のRNAが生成されていることが明らかになりました。このタンパク質をコードしないRNAはノンコーディングRNA(non-coding RNA: ncRNA)と呼ばれ、高等生物の複雑性の秘密を握る鍵かもしれないと、その役割が大きく注目されています。最近では、機能的なncRNAも含めて遺伝子と呼ぶ研究者も増えてきています。しかしながら、機能が明らかになっているncRNAはごく1部にすぎず、大部分は存在している意味があるのか不明でした。
タンパク質を作るmRNAの身代わりになるncRNAの発見
細胞内の遺伝子発現は幾重にも制御されていて、mRNAへと転写されてもタンパク質へ翻訳されるとは限りません。この翻訳制御を行う機構の1つとしてmicroRNA(miRNA)と呼ばれる19-24塩基程の小さなRNA達の存在が明らかになっています。一般的にmiRNAはmRNAの3'非翻訳領域に塩基配列特異的に結合し、その翻訳の抑制あるいは分解を促進することで標的遺伝子の発現を負に制御します。最近、miRNAはmRNA以外のncRNAにも結合することが報告されています。
昨年、これまで進化の過程でタンパク質をコードする機能を失った化石に過ぎないと考えられていた、ncRNAの一種である偽遺伝子は、自ら囮となることによりタンパク質をコードするmRNAをmiRNAから保護しているという報告がなされました。この現象を報告した研究グループは、miRNAを奪い合ってるようにも見えるこれらのRNAに対し"competing endogenous RNAs(ceRNA)"という呼び名を提唱しています。このceRNAという形式は、今まで機能が不明であった多くのncRNAの役割を説明しうる可能性を持つことのみならず、mRNAを含むmiRNAが結合する全てのRNAが参加することのできる「今まで隠れていた大規模なRNA間コミュニケーションネットワークを形成しうる」ことから注目されつつあります。
今回ご紹介させていただく論文の著者、Marcella Cesanaらは骨格筋特異的な新規ncRNAを同定し、その発現制御機構およびceRNAとしての機能を見出しています。
論文要約
新規ncRNAであるlinc-MD1の同定
著者のCesanaらはまず始めに、成熟した骨格でのみ発現しており、miRNAクラスター(※1)を形成しているmiR-133bとmiR-206に着目し、筋肉特異的な発現制御がどのように制御されているかを調べました。すると2つのmiRNAは1つの大きなncRNAの1部として転写されていることが明らかになりました。このncRNAはlong intergenic noncoding RNA(lincRNA)と呼ばれる種類のものでタンパク質をコードこそしませんがmRNAとよく似た構造を持ちます。彼らはこの新規lincRNAを"linc-MD1"と名付けました。予想通り、linc-MD1はmiR-133bとmiR-206と同じく、骨格筋特異的に発現していました。
linc-MD1の骨格筋特異的な発現制御機構の解析
次にCesanaらはlinc-MD1がどのようにして骨格筋特異的に発現しているのかを調べました。彼らはlinc-MD1の転写開始点周辺(プロモーター)の機能を調べました。すると(1)筋芽細胞という筋肉の赤ん坊ではプロモーターの活性は低く、骨格筋へと分化させると活性が上がること。(2)linc-MD1は自身の配列内にプロモーターの活性を劇的に高めるエンハンサーとして働く領域を持っていること(3)linc-MD1のプロモーター領域はエピジェネティック修飾(※2)によって筋芽細胞の状態ではロックされており、骨格筋への分化時にはこれらのロックが解除されていることが示されました。さらに、プロモーター、エンハンサー、転写終結点は3次元的に相互作用してGene loopと呼ばれる構造を取っていることが明らかになりました。
linc-MD1は骨格筋分化に対して意味を持つのか?
linc-MD1の骨格筋分化における役割を明らかにするため、CesanaらはsiRNA法(※3)を用いてマウスの培養筋芽細胞のlinc-MD1を破壊すると、筋芽細胞の筋分化が阻害されました。逆に培養筋芽細胞にlinc-MD1を過剰発現すると筋分化促進作用が見られました。このことからlinc-MD1は筋分化促進作用を持つncRNAであることが明らかになりました。
linc-MD1はceRNAとして働く?
では、どのようにしてlinc-MD1は骨格筋の分化を促進しているのでしょうか?CesanaらはceRNAの概念に着目し、linc-MD1に結合するmiRNAを探索しました。その結果、miR-133とmiR-135がlinc-MD1に結合することが分かりました。次に著者らは、miR-133はmaml-1を、miR-135がmef-2cを標的とすることを示しました。maml-1とmef-2cは共に筋肉の最終分化において重要な役割を担う因子です。Cesanaらはlinc-MD1はceRNAとして働いているかを確かめるため、マウス培養筋芽細胞を用いて詳細な解析を行いました。その結果、(1)筋分化の過程でmiR-133、miR-135の機能を抑制するとmaml-1、mef-2cの発現は2倍近く上昇しました。(2)linc-MD1をsiRNAで破壊するとmaml-1、mef-2cの発現は半分以下まで下がりました。(3)linc-MD1をsiRNAで破壊しても、miR-133、miR-135の機能を抑制するとmaml-1、mef-2cの発現は抑制されませんでした。(4)linc-MD1を過剰発現するとmaml-1、mef-2cの発現は上昇しました。これらの実験結果から、linc-MD1はmaml-1とmef-2cをmiR-133とmiR-135から保護することで筋分化を促進させていることが明らかになりました。つまり、linc-MD1はceRNAとして働くことが明らかとなったのです。
ヒトにおけるlinc-MD1の役割
これまでの解析は全てマウス由来の細胞株で行ってきました。最後にCesanaらはヒトの細胞を使ってlinc-MD1の役割を再確認しています。さらに、筋分化能が抑制されているデュシェンヌ型筋ジストロフィー(※4)の患者由来筋芽細胞においても、linc-MD1が筋分化を促進させる作用を発揮できるかをテストしています。結果は、不完全ではあるものの、デュシェンヌ型筋ジストロフィーの筋芽細胞でもlinc-MD1は筋分化促進作用を持つことが示されました。
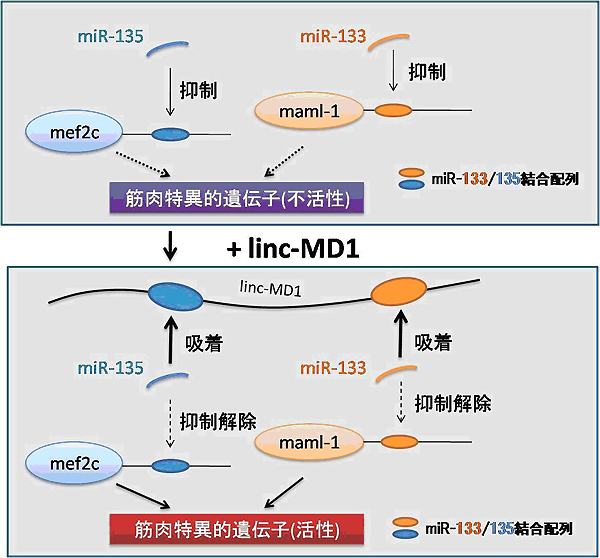
Cesana et al., Cell., 2011 Oct 14;147(2):358-69 Fig 7Cより改変引用
終わりに
本論文ではceRNAとして働くlincRNAの1例が示されました。この概念はlincRNAにとどまらず偽遺伝子や、今まで触れられなかったmRNAのノンコーディングな機能を今後明らかにしていく可能性があり今後の解析が期待されます。RNA達はmiRNAを媒介として、私達が思っている以上に多くの情報を交換しているのかもしれません。
用語解説
- ※1 miRNAクラスター
一つの転写産物にmiRNAが複数コードされているものをmiRNAクラスターと呼びます。これらのmiRNAは同時に転写されることになりますので、同様の発現動態を示すことになります。 - ※2 エピジェネティック修飾
DNAやヒストンと呼ばれるDNAが巻きついているタンパク質複合体に後天的に付加された化学的修飾の総称です。このエピジェネティックな修飾は遺伝子の発現をONにするものやOFFにするもの存在します。この化学的修飾は細胞分裂後の子孫細胞へも引き継がれていくことも知られています。一部の例外を除き、全身の細胞は同じゲノムを持っていますが、このエピジェネティックな修飾によって個々の細胞のキャラクターが決定されていると言われています。 - ※3 siRNA
22塩基程の低分子RNAを細胞内に導入することによって、任意のmRNAの分解を誘導する手法。この分解現象はRNAiと呼ばれます。また、siRNAによって引き起こされるRNAi は、miRNAによる遺伝子発現抑制機構と一部共通しています。ちなみにRNAi発見者のAndrew Z. FireとCraig Cameron Melloは2006年度ノーベル生理学賞を受賞しています。 - ※4 デュシェンヌ型筋ジストロフィー
筋ジストロフィーは成長するにつれて筋肉の萎縮と筋力低下を示す疾患の総称で、筋ジストロフィーの中でも最も多くみられるのがこのデュシェンヌ型筋ジストロフィーです。デュシェンヌ型筋ジストロフィーは性染色体劣性遺伝、すなわち原因遺伝子がX染色体上にあることによってXXの性染色体を持つ女性ではほとんどみられず、ほとんどがXYの性染色体を持つ男性において発症します。現在、この疾患に対する根治療法は確立されておりません。
Copyright © Keio University. All rights reserved.
