- 2012年度
- 2011年度
- 新たに判明 がんの転移を促進するメカニズム
(2012/03/23) - 神経発達と加齢における5-hmCを介したエピジェネティクス
(2012/03/23) - TACEを調節するiRhom2は、リステリア菌やLPSの反応により産生されるTNFを制御している
(2012/03/09) - HIV-2って何?
(2012/03/09) - 自殺遺伝子を持ったiPS細胞
(2012/03/09) - リハビリって神経幹細胞も殖やすんです!
(2012/02/24) - 癌幹細胞を制御するHippo pathway
(2012/02/10) - 吸血鬼が若い血を好むのには根拠があった?!~若い生き血でボケ防止~
(2012/02/10) - 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
(2012/01/27) - 骨の再生には、本来体を守る役割を持つはずのサイトカインは邪魔になる!?
(2012/01/27) - 骨格筋の老化は防げる?
(2012/01/13) - 意外に他力本願???他者の掘ったトンネルを行く癌細胞
(2012/01/13) - 新しいRNA間コミュニケーションのカタチ@筋肉
(2011/12/23) - 精子形成に必須なタンパク質Miwiによるトランスポゾンの発現抑制
(2011/12/23) - Dying well with dementia
(2011/12/09) - Recent insights into the epigenetic regulation of the hair follicle bulge stem cells
(2011/12/09) - ヒトiPS細胞から誘導した神経幹細胞における脳梗塞に対する移植治療の可能性
(2011/11/25) - 体細胞の再プログラム化を阻む"小さなRNA: miR-34"
(2011/11/25) - 薬剤性過敏症症候群 - DIHSがつなぐ薬疹とウイルスとの関連性
(2011/11/11) - 線維芽細胞より作製したドパミン作動性ニューロンは生体内において機能的であるのか?
(2011/11/11) - 終末分化した肝細胞から機能的な神経細胞への直接的な系統転換
(2011/10/28) - Nerves and T Cells Connect
(2011/10/28) - Rapid and robust generation of functional oligodendrocyte progenitor cells
(2011/10/28) - 脂肪細胞が発毛を促進する!?
(2011/10/14) - ADAM13はClass B Ephrinsの分解とWntシグナルの調節により頭部神経冠を誘導する
(2011/10/14) - 多能性の維持に働くchromatin remodeling複合体esBAF
(2011/09/30) - 造血幹細胞の維持にはp57が重要である
(2011/09/30) - IGF-II : 記憶力がよくなる分子!?
(2011/09/16) - 固形腫瘍に存在する間葉系幹細胞は癌幹細胞を増加させる
(2011/09/16) - 小腸は抑制性Th17細胞の宝庫
(2011/09/02) - 細胞周期を制御する新規noncoding RNA
(2011/09/02) - Sema3A play an important role in remyelination failure in multiple sclerosis
(2011/08/19) - Drosophila Sex lethal Gene initiates Female Development in Germline Progenitors
(2011/08/19) - Wnt signaling is a key pathway for regulation of Melanocyte stem cells.
(2011/08/05) - A step closer to understanding the heart
(2011/08/05) - 神経再生を阻む「死」のシグナル
(2011/07/25) - テロメラーゼの再活性化によりマウスの組織老化が回復する
(2011/07/25) - 新遺伝子「Glis1」により、安全なiPS細胞を高効率に作製可能
(2011/07/08) - 幹細胞の"状態"をつくりだす細胞外環境
(2011/07/08) - 毛包幹細胞、色素幹細胞を維持
(2011/06/24) - BCL6を標的とした白血病の新たな治療戦略
(2011/06/24) - 自家移植におけるiPS細胞の免疫応答について
(2011/06/03) - ヒト疾患iPS細胞のウィルソン病への応用
(2011/06/03) - FOP(進行性骨化性線維異形成症)の異所性骨化部の起源は?
(2011/04/22) - 非対称分裂がNotchシグナルの活性化を介して皮膚の分化を促進する
(2011/04/22) - ショウジョウバエの腸管幹細胞の増殖は活性酸素により制御される
(2011/04/22) - 線維芽細胞からの直接的なエピブラストステムセルの誘導
(2011/04/08) - 抗リウマチ薬DHODH阻害剤はメラノーマの進展を抑える
(2011/04/08) - 癌再発の指標になる幹細胞
(2011/04/08)
- 新たに判明 がんの転移を促進するメカニズム
- 2010年度
ホーム > 世界の幹細胞(関連)論文紹介 > 癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
癌幹細胞を特異的に標的とした治療法を開発できる可能性!?
論文紹介著者

吉武 桃子(博士課程 3年)
GCOE RA
歯科・口腔外科学教室
第一著者名・掲載雑誌・号・掲載年月
Takatsugu Ishimoto/Cancer Cell, 19, 387-400 (2011)
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Takatsugu Ishimoto, Osamu Nagano, Toshifumi Yae, Mayumi Tamada, Takeshi Motohara, Hiroko Oshima, Masanobu Oshima, Tatsuya Ikeda, Rika Asaba, Hideki Yagi, Takashi Masuko, Takatsune Shimizu, Tomoki Ishikawa, Kazuharu Kai, Eri Takahashi, Yu Imamura, Yoshifumi Baba, Mitsuyo Ohmura, Makoto Suematsu, Hideo Baba, Hideyuki Saya. Cancer Cell, 19, 387-400 (2011)
論文解説
近年、癌組織中には自己複製能を持ち、異なる分化段階の細胞を産生する能力を有する細胞である癌幹細胞の存在が知られており、癌における抗癌剤・放射線治療に対する抵抗性や癌の再発には、癌幹細胞の存在が関与していると考えられています。癌幹細胞における特異的なマーカーやその機能を解析することが新たな癌の診断や治療につながると考えられており、各種癌において癌幹細胞の同定に向けて活発な研究がおこなわれてきました。なかでも乳癌、膵臓癌、胃癌、頭頸部癌などの固形癌ではCD44陽性の癌細胞は免疫不全マウスへの腫瘍形成能力が高く、CD44陽性癌細胞が癌幹細胞としての特性を持つことが報告されています。しかしながら、治療抵抗性を有する癌細胞におけるCD44発現意義を分子レベルで解明するに至りませんでした。
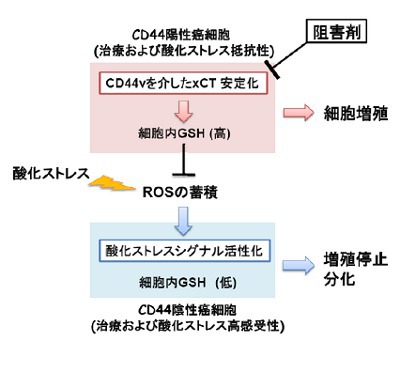
そこでこの論文では、CD44が単なる幹細胞マーカーとしての役割だけでなく、癌細胞内の活性酸素(Reactive oxygen species; ROS)の蓄積を抑制し治療抵抗性に寄与するという新しい機能を有することを見出しました。
まず、CD44 高発現および低発現の消化器癌細胞株を用いてCD44 の発現状態とROS の関連性を調べました。ROS の量を検出できる蛍光プローブを用いて細胞内のROS を定量化した結果、CD44高発現株においては細胞内ROS の蓄積が生じにくく、反対にCD44 低発現株ではROS の蓄積が生じやすいことが分かりました。次に、このROS 量の調節がCD44 によるものかを検証するために、CD44 高発現癌細胞においてCD44 の発現をRNA 干渉法を用いて抑制してみると、細胞内ROS の蓄積が誘導できるようになることから、CD44 がROS の蓄積を抑える何らかの機能を有していることが分かりました。
そこで次に、その分子機構を解析した結果、非酵素性の抗酸化物質であるグルタチオンの細胞内含有量がCD44 発現抑制により著明に低下し、細胞内ROS の蓄積を誘導することが分かりました。さらに、CD44バリアントが特異的にグルタチオン合成の材料となる細胞外シスチン(アミノ酸の1つ)の取り込みに関わるトランスポーターxCTを細胞膜上で安定化させることで、その抑制機能を高めることが分かりました。この結果から、CD44バリアントを高発現する癌細胞ではシスチントランスポーターが細胞膜上で安定化されるとともに、GSH生成が亢進しており、酸化ストレスを回避しやすいようになっていることが、さらなる腫瘍形成や進展に繋がっていると考えられました。
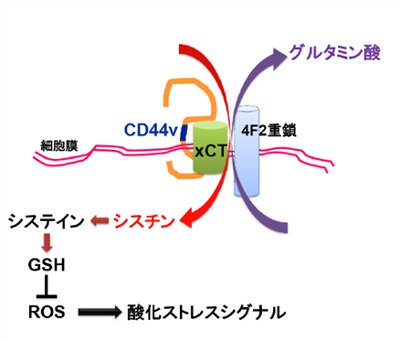
細胞内ROS の蓄積は、酸化ストレスシグナルであるp38MAPK やp21 の活性化を誘導し、癌の増殖および進展を抑制することが知られています。自然発症型胃癌マウスモデルを解析したところCD44 が発現している癌細胞ではこれらの酸化ストレスシグナルの活性化が抑えられていることが分かりました。
そこで、金沢大学がん研究所において開発された胃癌発症モデルマウスとCD44 ノックアウトマウスを交配し、CD44 ノックアウト胃癌マウスを作製して、生体レベルでのCD44 の機能解析を行いました。その結果、CD44 発現の抑制は腫瘍の増大に対して明らかな抑制効果を持つこと、またその際に酸化ストレスシグナルp38MAPK 活性化およびp21 の発現上昇が誘導されることが示されました。次に、CD44v-xCTの阻害が癌治療のターゲットになり得るかをxCT特異的阻害剤sulfasalazineを用いて検討しました。大腸癌細胞株HCT116細胞はCD44バリアントが高発現しており、RNA干渉法によるCD44ノックダウンによってヌードマウス皮下腫瘍の生育が阻害されることからCD44依存的に腫瘍を形成すると考えられます。そこでHCT116細胞をヌードマウスに皮下移植後、xCT特異的阻害剤sulfasalazineの効果を検討したところ、sulfasalazineは腫瘍抑制効果を有することが分かりました。また一般的な抗癌剤であるシスプラチンとの併用実験では、xCTの阻害はシスプラチンの効果を増強させることが分かりました。以上の解析結果から、CD44v-xCTを介した細胞内ROS制御機構は腫瘍形成および治療抵抗性に寄与していることが示されました。
これらの結果から、CD44 を介した細胞内ROS 抑制機構は、腫瘍の増大や治療に対する抵抗性に寄与していることが分かりました。つまりCD44バリアント の発現が高い癌においてはCD44 やxCT を標的とした治療を行うことで、癌幹細胞を特異的に標的とした新しい治療法を開発できる可能性を示しています。
用語解説
- CD44陽性癌細胞
細胞表面にCD44というタンパク質を持つ細胞
Copyright © Keio University. All rights reserved.
