- 2012年度
- 2011年度
- 2010年度
- 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
(2011/03/25) - リプログラミングを促進する小さなRNA
(2011/03/25) - ⊿Np63は転写因子Lshを介して、がん幹細胞の増加を促す
(2011/03/25) - 造血幹細胞のメンテナンスを行う新たな因子の発見
(2011/03/04) - マウスES細胞から神経細胞への分化を方向づける因子の発見
(2011/03/04) - ヒト疾患iPS細胞:自閉症レット症候群への応用
(2011/02/18) - 生きかえる心臓
(2011/02/18) - グリオブラストーマ幹細胞様細胞は内皮細胞へ分化し、血管新生を誘導する
(2011/02/04) - 血液の幹細胞を保存状態と臨戦態勢に分類するNカドヘリン
(2011/02/04) - 急性骨髄性白血病のがん幹細胞への集中的治療を可能にするTIM-3
(2011/01/21) - p53の機能の回復を対象とした、がんの治療法には限界がある?
(2011/01/21) - 前立腺癌は分泌細胞、基底細胞のどちらに由来するのか?
(2011/01/07) - 癌細胞をリプログラミングする
(2011/01/07) - 造血幹細胞のエネルギー代謝や恒常性は、Lkb1によって調節される
(2010/12/24) - G-CSFによる造血幹細胞の末梢血への動員がEGFRシグナルの阻害により増強される
(2010/12/24) - 恐竜は何色?
(2010/12/10) - ヒト胚性幹細胞から軟骨細胞への分化誘導
(2010/12/10) - ヒト皮膚細胞から人工造血細胞への驚くべき変換
(2010/11/26) - ただ一つの遺伝子をヒトの皮膚細胞に導入し血液のもとになる細胞を作り出すことに成功
(2010/11/26) - TAp63のDicerを介した転移抑制機構
(2010/11/12) - ヒト細胞における、エンハンサー的機能をもつ長鎖ノンコーディングRNAの発見
(2010/11/12) - 毛包の前駆細胞から生じるSKPs(皮膚由来多能性前駆細胞)は、成人真皮幹細胞としての特性を示す
(2010/10/29) - X染色体上の遺伝子発現を正常化させると、体細胞クローン胚の生産効率は著しく向上する
(2010/10/29) - miR-9は乳癌においてE-cadherinの発現を抑制し、癌転移を促進する
(2010/10/15) - 間葉系幹細胞と造血幹細胞が形成する独特な骨髄ニッチ
(2010/10/15) - 細胞運命決定因子Musashiによる白血病の制御
(2010/10/01) - 単一のLgr5幹細胞からのin vitroでの陰窩・絨毛構造の構築
(2010/10/01) - 造血幹細胞は、インターフェロンγによって活性化される
(2010/09/17) - iPS細胞に残る由来細胞の記憶
(2010/09/17) - 生後の海馬の神経新生は、記憶(恐怖連合記憶)の情報処理(海馬依存的な期間)を制御する
(2010/09/03) - 核質に存在するヌクレオポリンは発生と細胞周期に関連する遺伝子の発現に直接的に関与している
(2010/09/03)
- 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
ホーム > 世界の幹細胞(関連)論文紹介 > 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
論文紹介著者

川村 直(博士課程 2年)
GCOE RA
先端医科学研究所細胞情報研究部門
第一著者名・掲載雑誌・号・掲載年月
Zhonghan Li/Cancer Cell, Volume 19, 2011
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Michael Quante, Shui Ping Tu, Hiroyuki Tomita1, Tamas Gonda, Sophie S.W. Wang1, Shigeo Takashi, Gwang Ho Baik, Wataru Shibata, Bethany DiPrete, Kelly S. Betz, Richard Friedman, Andrea Varro, Benjamin Tycko and Timothy C. Wang
Zhonghan Li/Cancer Cell, Volume 19, p.257-272, 2011
論文解説
はじめに
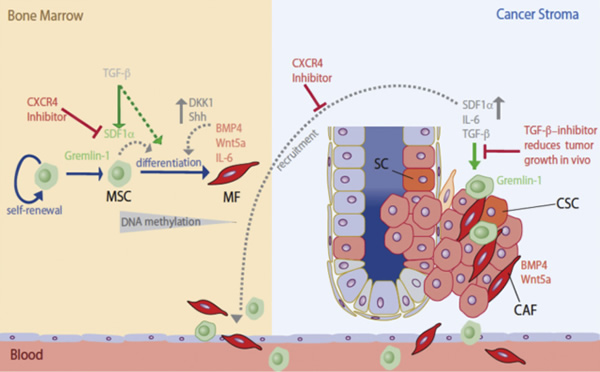
腫瘍組織には癌細胞に加えて、マクロファージ(Mø)やT細胞をはじめとした免疫細胞、血管やリンパ管を構成している細胞、線維芽細胞や間葉系幹細胞(MSC : Mesenchymal stem cell)などの細胞が存在し、「癌微小環境」を構築しています。これら癌微小環境を構成する細胞は、様々な増殖因子やサイトカイン、ケモカインを産生することで、癌幹細胞の維持や癌細胞の増殖、浸潤転移などを制御していることが判明しています。 癌微小環境を構成する主要な細胞集団の1つに癌関連繊維芽細胞(CAF : Cancer associated fibroblast)と呼ばれる細胞集団が存在します。このCAFは、a-SMA(a-smooth muscle actin)を発現しており、癌の進展を多面的に促進することが知られていますが、CAFが一体どの細胞由来であるかがはっきりしていません。これまでの研究では、組織性の繊維芽細胞や血管内皮細胞、もしくはMSCがCAFの候補であると考えられています。また、筋繊維芽細胞(MF : Myofibroblast)はa-SMAを発現しており、CAFとMFは性質が似ていることが示唆されています。今回紹介する論文では、胃の炎症性発癌モデルを利用して、腫瘍局所存在しているCAFのうち、約20%は骨髄に存在しているMSCに由来していることを示しています。
炎症と発癌
慢性的な炎症によって癌が誘発されることは昔から知られていました。既に1915年には、山極博士がウサギの耳にコールタールを塗布して炎症を引き起こし、世界で初めて人工的にがんを作り出しています。慢性炎症と深いかかわりあいのある癌としては、慢性潰瘍性大腸炎やクローン病によって大腸がんが,C型肝炎ウイルス感染で起こる慢性肝炎によって肝細胞がんが誘発される。また、今回紹介する論文では、ピロリ菌感染による慢性胃炎が胃癌を誘発することも知られています。慢性炎症による発癌は、「慢性炎症⇒縮退⇒変質形成⇒異形成⇒腫瘍形成」という時系列で誘発されると考えられています。
炎症部位にあつまるa-SMA陽性繊維芽細胞
ピロリ菌感染前の胃には、a-SMAを発現している繊維芽細胞は殆どいません。しかし、感染後12~18ヶ月には、a-SMAを発現している繊維芽細胞が胃の炎症部位に増加します。特に、異型性から腫瘍形成に至る過程においてa-SMA陽性の繊維芽細胞(論文中ではCAFと記載)は急激に増加していることが判明しました。
では、このa-SMA陽性の繊維芽細胞はどこから来たのでしょうか?著者らは、IL-1bを高発現するマウスに、GFP陽性、a-SMA-RFP、ダブル陽性の骨髄細胞を移植し、ピロリ菌感染によって発癌を引き起こし、癌局所に集積する細胞がどこ由来なのかを検証しました。その結果、骨髄由来のGFP陽性細胞やa-SMA-RFP細胞が癌局所に集積していることが判明し、そのうちの約20%はGFP陽性かつa-SMAを発現している細胞でありました。また、これらの細胞は、CXCL-1やCCL-5、MMP-9、IL-6、SDF-1、TNF-aなど、炎症を促進したり、免疫系の細胞の遊走に関与するサイトカインやケモカインを産生していることが判明し、腫瘍局所の微小環境において、これらの細胞集団が免疫細胞のお遊走のみならず炎症の増強などを引き起こすことが明らかとなりました。
a-SMA陽性CAFはMSC由来の細胞集団
では、腫瘍局所に存在するa-SMA陽性のCAFは骨髄の一体どの細胞由来なのでしょうか?著者らは、a-SMA-RFPマウスないしIL-1b高発現のa-SMA-RFPマウスにピロリ菌感染によって発癌を誘導した結果、RFP陽性細胞が急激に増加しました。つまり、感染によって骨髄のリモデリングが起こった結果、RFP陰性の骨髄細胞がRFP陽性の細胞(a-SMA陽性の細胞)に変化したことになります。次に著者らは、骨髄細胞から接着法によってMSCを分離し長期培養を行ったところ、MSCの一部からRFP陽性(a-SMA陽性)細胞が発生してきました。また、長期培養した細胞RFP陽性ないしRFP陰性にFACSで単離して培養を試みたところ、RFP陽性の細胞では細胞老化が誘導され増殖されない一方で、RFP陰性細胞は増殖する一方でRFP陽性の細胞が再度発生することが示されました。また、RFP陰性とRFP陽性の細胞を、脂肪細胞、骨芽細胞、軟骨細胞へと分化させたところ、RFP陰性の細胞が有意に分化することが判明しました。つまり、RFP陰性のMSCが骨髄のリモデリングでa-SMA陽性のCAFへと分化し、腫瘍局所に集積したことが、これらの実験で明らかとなりました。また、これらの方法で単離したMSCもしくはCAFと癌細胞を一緒にマウスに移植したところ、腫瘍の増殖を大きく促進することが示されました。
今回紹介した論文では、骨髄中のMSCが、炎症から発癌に変化する際にa-SMA陽性のCAFへと分化し、癌局所へと移動し癌微小環境と構築することを示した論文です。最近の論文では、癌局所の間質細胞集団が癌の増殖のみならず癌そのものの浸潤転移など癌の悪性度を増強させることが報告されており、癌間質を制御することが今後の癌研究において重要であると考えます。
Copyright © Keio University. All rights reserved.
