- 2012年度
- 2011年度
- 2010年度
- 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
(2011/03/25) - リプログラミングを促進する小さなRNA
(2011/03/25) - ⊿Np63は転写因子Lshを介して、がん幹細胞の増加を促す
(2011/03/25) - 造血幹細胞のメンテナンスを行う新たな因子の発見
(2011/03/04) - マウスES細胞から神経細胞への分化を方向づける因子の発見
(2011/03/04) - ヒト疾患iPS細胞:自閉症レット症候群への応用
(2011/02/18) - 生きかえる心臓
(2011/02/18) - グリオブラストーマ幹細胞様細胞は内皮細胞へ分化し、血管新生を誘導する
(2011/02/04) - 血液の幹細胞を保存状態と臨戦態勢に分類するNカドヘリン
(2011/02/04) - 急性骨髄性白血病のがん幹細胞への集中的治療を可能にするTIM-3
(2011/01/21) - p53の機能の回復を対象とした、がんの治療法には限界がある?
(2011/01/21) - 前立腺癌は分泌細胞、基底細胞のどちらに由来するのか?
(2011/01/07) - 癌細胞をリプログラミングする
(2011/01/07) - 造血幹細胞のエネルギー代謝や恒常性は、Lkb1によって調節される
(2010/12/24) - G-CSFによる造血幹細胞の末梢血への動員がEGFRシグナルの阻害により増強される
(2010/12/24) - 恐竜は何色?
(2010/12/10) - ヒト胚性幹細胞から軟骨細胞への分化誘導
(2010/12/10) - ヒト皮膚細胞から人工造血細胞への驚くべき変換
(2010/11/26) - ただ一つの遺伝子をヒトの皮膚細胞に導入し血液のもとになる細胞を作り出すことに成功
(2010/11/26) - TAp63のDicerを介した転移抑制機構
(2010/11/12) - ヒト細胞における、エンハンサー的機能をもつ長鎖ノンコーディングRNAの発見
(2010/11/12) - 毛包の前駆細胞から生じるSKPs(皮膚由来多能性前駆細胞)は、成人真皮幹細胞としての特性を示す
(2010/10/29) - X染色体上の遺伝子発現を正常化させると、体細胞クローン胚の生産効率は著しく向上する
(2010/10/29) - miR-9は乳癌においてE-cadherinの発現を抑制し、癌転移を促進する
(2010/10/15) - 間葉系幹細胞と造血幹細胞が形成する独特な骨髄ニッチ
(2010/10/15) - 細胞運命決定因子Musashiによる白血病の制御
(2010/10/01) - 単一のLgr5幹細胞からのin vitroでの陰窩・絨毛構造の構築
(2010/10/01) - 造血幹細胞は、インターフェロンγによって活性化される
(2010/09/17) - iPS細胞に残る由来細胞の記憶
(2010/09/17) - 生後の海馬の神経新生は、記憶(恐怖連合記憶)の情報処理(海馬依存的な期間)を制御する
(2010/09/03) - 核質に存在するヌクレオポリンは発生と細胞周期に関連する遺伝子の発現に直接的に関与している
(2010/09/03)
- 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
ホーム > 世界の幹細胞(関連)論文紹介 > miR-9は乳癌においてE-cadherinの発現を抑制し、癌転移を促...
miR-9は乳癌においてE-cadherinの発現を抑制し、癌転移を促進する
論文紹介著者

道口 洵也(博士課程 4年)
GCOE RA
病理学教室
第一著者名・掲載雑誌・号・掲載年月
Li Ma/Nature Cell Biology, 12(3): 247-56, 2010
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Li Ma, Jennifer Young, Harsha Prabhala, Elizabeth Pan, Pieter Mestdagh, Daniel Muth, Julie Teruya-Feldstein, Ferenc Reinhardt, Tamer T. Onder, Scott Valastyan, Frank Westermann, Frank Speleman, Jo Vandesompele and Robert A. Weinberg. miR-9, a MYC/MYCN-activated microRNA, regulates E-cadherin and cancer metastasis. Nat Cell Biol. 12(3):247-56, 2010
論文解説
ゲノム上にコードされた遺伝情報は、mRNA(メッセンジャーRNA)に転写、タンパク質へと翻訳されます。タンパク質は細胞を構築する成分であり、細胞の機能を定める重要な役割を担っているのです。近年、そのタンパク質の産生を制御する機構としてmiRNA(マイクロRNA)※1が注目されています。miRNAによる遺伝子発現制御システムは、個体の発生や分化において必須であるだけでなく、癌をはじめとする様々な疾患においてその発現異常が見られることから、病態の成立にも関与することが明らかになってきています。今回は、miRNAのひとつmiR-9に着目し、癌の転移への影響を分子レベルで解明、さらにその臨床的意義を明らかにした論文を紹介したいと思います。
癌の転移は、癌患者の予後を左右し、実際に多くの患者が亡くなる原因となっています。その転移に関わる現象としてEMT(上皮間葉転換)と呼ばれる概念があります。簡単に言うと、癌細胞が細胞接着を介して細胞集団を形成している状態(上皮様)から、細胞接着を喪失、高い運動能と浸潤能を獲得した動きやすい状態(間葉様)へと変化する現象です。細胞接着に関与する代表的な分子であるE-cadherin(カドヘリン)は、EMTの獲得に伴ってその発現が抑制されることから、EMTの指標としてよく用いられています。このようなE-cadherinを標的とするmiRNAが、本論文の主役となるmiR-9です。
<miR-9の機能解析>
Li等は、乳癌で高発現が認められるmiR-9の機能を探るべく、乳癌細胞および乳腺上皮細胞にmiR-9を強制発現させ、E-cadherinの発現への影響を評価しました。その結果、両細胞において、E-cadherinの発現が抑制されることがわかり、さらに運動能と浸潤能への影響を検討したところ、ともに亢進していることが明らかとなりました。
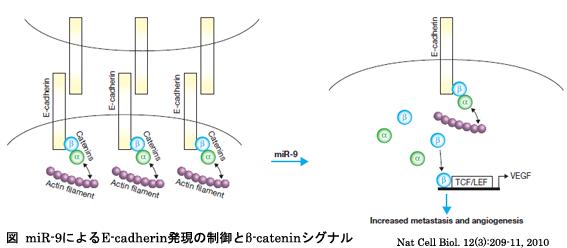
miR-9発現によるE-cadherinの抑制によって、細胞内シグナル伝達系はどのような影響を受けるのでしょうか?E-cadherinは細胞膜上に局在し、細胞間の接着に関与する一方で、細胞内ドメインはβ-catenin(カテニン)と相互作用しています。蛍光染色法より、β-cateninの細胞内局在を見てみると、β-cateninは細胞膜から細胞質あるいは核に変化していることがわかりました。このことは、β-cateninが核内で転写因子として働くことを意味し、実際に標的遺伝子であるVEGF(血管内皮細胞増殖因子)の発現亢進が認められました(図)。その表現型はマウスに細胞を移植し、形成した腫瘍から観察され、実際に腫瘍内血管数が有意に増加していました。このような血管の増加は、血管新生と呼ばれ癌細胞の生存や転移に有利に働く機構として知られています。
一方で、miR-9自体の発現制御は何によってなされているのでしょうか?これまでに、癌遺伝子であるMYCは、腫瘍形成にプラスとなるmiRNAの発現を直接的に制御しているという報告があります。そこで、Li等はMYCを強制発現させ、miR-9の発現量を評価してみたところ、コントロールに対して発現レベルが約3倍高くなっていることがわかりました。このことから、miR-9もまた癌遺伝子MYCにより、活性化されていることが明らかとなったのです。
<miR-9の癌転移との関連性>
最後に、Li等は癌転移におけるmiR-9発現の影響を検討するため、miR-9を発現させた乳癌細胞と発現させていない細胞をそれぞれマウスに移植しました。その結果として、miR-9発現群において、癌細胞の肺転移が有意に認められました。さらにmiR-9発現を阻害する実験では、逆に転移が抑制されることを示しています。
実際に、ヒトの乳癌症例においてmiR-9発現に意味があるのかどうかを調べてみると、転移が見られた症例では、転移が見られなかった症例に対して、miR-9の発現が有意に高いことが明らかとなりました。この結果は、miR-9の癌転移への関与を強く支持しているものと言えます。
<結論>
miR-9は、転移を抑制する主要分子E-cadherinを負に制御する転移促進性microRNAであることが明らかとなりました。E-cadherinの発現制御は、これまでプロモーター領域のメチル化や転写因子が関与していることが知られていましたが、今回の報告より、microRNAによる直接的な制御の存在が明らかになったのです。このような機構は乳癌に限らず、他の癌においてもEMTや転移に関与しているものと考えられます。
用語解説
- ※1 miRNA(microRNA:マイクロRNA)
miRNAは約22塩基からなる一本鎖RNAであり、相補的な配列を持った標的mRNAに作用し、翻訳阻害もしくは分解し、発現の調節を行っている。一種類のmiRNAは複数のmRNAを標的とすることが知られている。
Copyright © Keio University. All rights reserved.
