- 2012年度
- 2011年度
- 2010年度
- 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
(2011/03/25) - リプログラミングを促進する小さなRNA
(2011/03/25) - ⊿Np63は転写因子Lshを介して、がん幹細胞の増加を促す
(2011/03/25) - 造血幹細胞のメンテナンスを行う新たな因子の発見
(2011/03/04) - マウスES細胞から神経細胞への分化を方向づける因子の発見
(2011/03/04) - ヒト疾患iPS細胞:自閉症レット症候群への応用
(2011/02/18) - 生きかえる心臓
(2011/02/18) - グリオブラストーマ幹細胞様細胞は内皮細胞へ分化し、血管新生を誘導する
(2011/02/04) - 血液の幹細胞を保存状態と臨戦態勢に分類するNカドヘリン
(2011/02/04) - 急性骨髄性白血病のがん幹細胞への集中的治療を可能にするTIM-3
(2011/01/21) - p53の機能の回復を対象とした、がんの治療法には限界がある?
(2011/01/21) - 前立腺癌は分泌細胞、基底細胞のどちらに由来するのか?
(2011/01/07) - 癌細胞をリプログラミングする
(2011/01/07) - 造血幹細胞のエネルギー代謝や恒常性は、Lkb1によって調節される
(2010/12/24) - G-CSFによる造血幹細胞の末梢血への動員がEGFRシグナルの阻害により増強される
(2010/12/24) - 恐竜は何色?
(2010/12/10) - ヒト胚性幹細胞から軟骨細胞への分化誘導
(2010/12/10) - ヒト皮膚細胞から人工造血細胞への驚くべき変換
(2010/11/26) - ただ一つの遺伝子をヒトの皮膚細胞に導入し血液のもとになる細胞を作り出すことに成功
(2010/11/26) - TAp63のDicerを介した転移抑制機構
(2010/11/12) - ヒト細胞における、エンハンサー的機能をもつ長鎖ノンコーディングRNAの発見
(2010/11/12) - 毛包の前駆細胞から生じるSKPs(皮膚由来多能性前駆細胞)は、成人真皮幹細胞としての特性を示す
(2010/10/29) - X染色体上の遺伝子発現を正常化させると、体細胞クローン胚の生産効率は著しく向上する
(2010/10/29) - miR-9は乳癌においてE-cadherinの発現を抑制し、癌転移を促進する
(2010/10/15) - 間葉系幹細胞と造血幹細胞が形成する独特な骨髄ニッチ
(2010/10/15) - 細胞運命決定因子Musashiによる白血病の制御
(2010/10/01) - 単一のLgr5幹細胞からのin vitroでの陰窩・絨毛構造の構築
(2010/10/01) - 造血幹細胞は、インターフェロンγによって活性化される
(2010/09/17) - iPS細胞に残る由来細胞の記憶
(2010/09/17) - 生後の海馬の神経新生は、記憶(恐怖連合記憶)の情報処理(海馬依存的な期間)を制御する
(2010/09/03) - 核質に存在するヌクレオポリンは発生と細胞周期に関連する遺伝子の発現に直接的に関与している
(2010/09/03)
- 骨髄由来の筋繊維芽細胞は間葉系幹細胞のニッチの構築と腫瘍増殖を促進する
ホーム > 世界の幹細胞(関連)論文紹介 > 造血幹細胞は、インターフェロンγによって活性化される
造血幹細胞は、インターフェロンγによって活性化される
論文紹介著者

千葉 紗由利(博士課程 4年)
GCOE RA
微生物学・免疫学教室
第一著者名・掲載雑誌・号・掲載年月
Megan T/Nature, Volume: 465, Pages: 793-797.
文献の英文表記:著者名・論文の表題・雑誌名・巻・号・ページ・発行年(西暦)
Megan T. Baldridge, Katherine Y. King, Nathan C. Boles, David C. Weksberg & Margaret A. Goodell. Quiescent haematopoietic stem cells are activated by IFN-γ in response to chronic infection. Nature, 2010, Volume: 465, Pages: 793-797.
論文解説
<新規性>
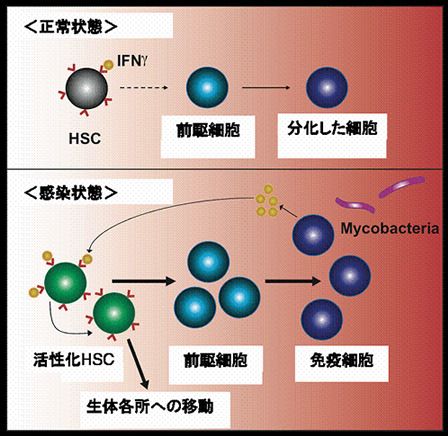
生体で感染が起こると、体内では免疫細胞が減少します。しかしこの論文では、感染に対して免疫細胞が産生したインターフェロンγ(IFN-γ)というタンパクが、骨髄中の造血幹細胞(HSC)を刺激して、新たな免疫細胞を骨髄から様々な臓器へ補充させる能力があることが報告されています。
この研究結果によって、HIV/AIDSや結核といった慢性の感染症や骨髄移植後など、免疫細胞が減少している患者の治療薬として、IFN-γを使用できる可能性が開かれました。
<実験の背景と目的>
多くの免疫細胞は、骨髄に存在する造血幹細胞(HSC)という細胞から分化します。このHSCは、赤血球や血小板、そして免疫応答を担当する白血球などの様々な細胞に分化する能力を持っています。HSCは、骨髄の中で様々な種類の前駆細胞へと分化して、骨髄から血液に乗って全身をめぐります。そして、各リンパ節や臓器組織で、様々な免疫細胞に成熟し、免疫応答ができるようになります。
生体で感染が起こると、体内を循環している血液中のリンパ球と好中球といった免疫細胞は、細菌を排除するために戦い、数が減少してしまいます。生体でHIVや結核などの慢性的な感染が起こると、前駆細胞は免疫細胞の産生を増加させることで、生体を回復させ、正常に戻そうとします。しかし、HSCが、どのようなメカニズムで免疫細胞数の回復に関与しているかは解明されていません。
そこでBaldridgeらは、なぜ感染によってHSCが増殖するのかを解明するために実験を行いました。そして、トリ型結核菌であるM.aviumを感染させたマウスを解析したところ、マウスの体内で産生されるIFN-γというタンパクが、HSCを強く刺激し、新たな免疫細胞の産生を促進していることを明らかにしました。IFN-γとは、活性化された免疫細胞から産生され、様々な細胞の活性化や増殖、分化に影響を与えることで、生体の炎症反応や免疫応答の調節をすることができるタンパクの一種です。
<感染に応答して増殖する幹細胞は、どのタイプの幹細胞なのか?>
まず、マウスにM.aviumを感染させ、どのような種類のHSCが感染後の体内で大きく変化するかを調べました。その結果、M.aviumが感染している間、長期造血幹細胞(LT-HSC)の割合だけが一ヶ月にわたって増殖を続けていました。
しかし、本来は分化しなければならないHSCが増殖を続けてしまっているということは、このHSCの性質が変化してしまっている可能性が考えられます。例えば、HSCが本来持っているはずの分化能を失っていたり、このHSCを移植しても通常のHSCのように定着しなくなっているなどの可能性です。
そこで、M.aviumに感染したマウスからLT-HSCを回収して、ドナーとなる非感染のマウスにこの細胞を移植する実験を行いました。マウスでも、ヒトの骨髄移植と同様に、ドナーには放射線を照射し、ドナーマウス自身の骨髄細胞がすべて機能しないようにしてあります。
このLT-HSCを移植されたマウスを解析したところ、本来、免疫細胞に分化するはずのこの細胞が増殖状態にあったため、移植した細胞がドナーマウスに定着しませんでした。
つまり、感染によって増殖しているHSCは、本来のHSCの「分化」という性質を失い、新たに「増殖」という能力を得ていることがわかりました。
<IFN-γは、造血幹細胞の増殖を制御しているのか?>
マウスがM.aviumに感染すると、体内のIFN-γの量が増加します。このことより、Baldridgeらは、IFN-γがHSCの増殖に関与しているのではないかと考え、M.avium を感染させたマウスの骨髄中のIFN-γ量を測定しました。その結果、感染マウスのIFN-γの産生量は非感染マウスの3倍以上になりました。
次にBaldridgeらは、HSCが体内を移動するのにIFN-γが関わるかを調べました。なぜなら、M.aviumに感染したマウスの脾臓中には大量のLT-HSCが存在しており、LT-HSCが骨髄から脾臓へ移動している可能性が高かったからです。
そこで、生体のIFN-γの産生を阻害したら、LT-HSCもIFN-γを産生できないため、感染に対する応答が低下するのではないかと考えました。
彼らは体中のIFN-γの受容体が欠損したIFN-γ受容体欠損マウスと、IFN-γを産生する経路の下流に存在する分子のSTAT1を欠損したマウスにM.aviumを感染させました。STAT1はシグナル伝達性転写因子の一つで、様々な細胞の増殖、分化および生存などの過程を制御するタンパクの一種です。
その結果、これらの欠損マウスのLT-HSCには増殖能がなく、脾臓中のHSCの数も変化しませんでした。これに対し、IFN-αを欠損したマウスでは、正常なマウスと同様に、感染に対してHSCが増殖し、脾臓中のHSCの数も増加しました。
この結果から、感染に応答してHSCを増加させるのに重要なのはIFN-αではなく、IFN-γであることがわかりました。
<IFN-γだけで、造血幹細胞の増殖を制御できるのか?>
次に、IFN-γが直接にLT-HSCを刺激しているのかを検証しました。LT-HSCはIFN-γの受容体1(Ifngr1)をもっているため、IFN-γに直接応答ができます。そこでBaldridgeらは、HSCに発現しているIfngr1の量を測定しました。
これまでに、T細胞、B細胞、顆粒球、赤血球といった他の免疫細胞は、このIfngr1を高く発現していることが知られていました。しかしHSCは、これら免疫細胞の100倍以上のIfngr1を発現していました。つまりHSCがIFN-γに応答する能力は、成熟した免疫細胞よりも顕著に高いということです。
そこで、さらにIFN-γだけでHSCの増殖や移動などに影響を与えられるのかを調べるため、今後は直接HSCにIFN-γを加えて、IFNに誘導されて発現が上昇するIrgm1の発現量を測定しました。Irgm1は、細胞内病原体に対する防御機構に関与することが知られている酵素の一種です。
その結果、HSCでは、Irgm1の発現量も増加しました。また、Ifngr1欠損マウスやSTAT1欠損マウスでは、Irgm1が変化しませんでした。つまり、IFN-γは、単独でHSCの増殖を誘導できることが判りました。
さらにこの現象が、実際にマウスの体内でも起こるのかを確認するために、マウスに直接rIFN-γを投与したところ、マウスの体内でもLT-HSCの増殖能が上昇しました。さらに、rIFN-γ投与マウスの骨髄をドナーマウスに移植し、その生着率を調べました。
これまでの結果からすると、IFN-γによって増殖したHSCは分化能が低いため、骨髄移植を行っても生着しないと考えられます。
やはり実験結果も、rIFN-γを投与していないマウスの骨髄に比べて、IFN-γを投与したマウスの細胞は、生着率が低下していました。さらに、rIFN-γ投与マウスは、非投与マウスに比べて、脾臓中のLT-HSC量が倍存在していたことから、移動能も高いと考えられました。
これらの結果から、IFN-γには、HSCに直接作用して、HSCを「増殖」させ、骨髄から「移動」させることが明らかになりました。
<結論>
ここまでに、IFN-γがHSCが増殖し、遊走するのに必要で十分であることがわかりました。IFN-γ欠損マウスの骨髄に存在するLT-HSCは正常なマウスと同様です。しかし、IFN-γ欠損マウス由来のHSCは、非感染状態であっても増殖速度が遅く、数も正常マウスの半分程度しか存在しません。これよりIFN-γは、感染の有無に関わらず、HSC活性を調節しているものと考えられます。
このようにBaldridgeらは、HSCを強く刺激し、「増殖」や「移動」をさせるのはIFN-γであることを、M.aviumに感染したマウスを使って明らかにしました。
Copyright © Keio University. All rights reserved.
