- ホーム
- 今月のサイエンス一覧
-
今月のサイエンス
今月のサイエンス - 2023年01月
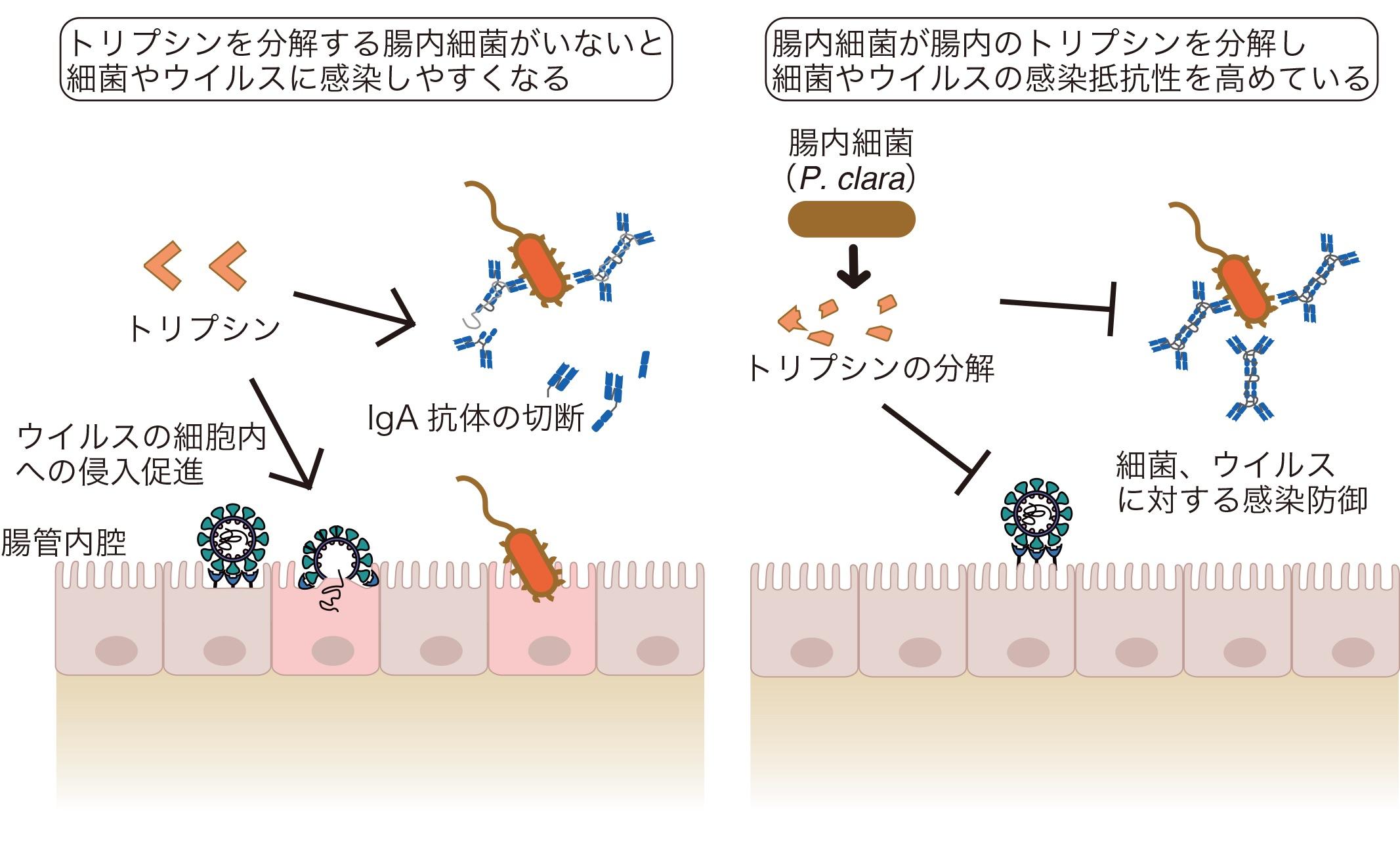
1: Identification of trypsin-degrading commensals in the large intestine.
Nature.
2022;609(7927):582-+. [Article]
Li YX, Watanabe E, Kawashima Y, Plichta DR, Wang ZJ, Ujike M, Ang QY, Wu RR, Furuichi M, Takeshita K, Yoshida K, Nishiyama K, Kearney SM, Suda W, Hattori M, Sasajima S, Matsunaga T, Zhang XX, Watanabe K, Fujishiro J, Norman JM, Olle B, Matsuyama S, Namkoong H, Uwamino Y, Ishii M, Fukunaga K, Hasegawa N, Ohara O, Xavier RJ, Atarashi K, Honda K.

本研究では、マウス腸内容物に含まれる宿主タンパク質の網羅的解析(プロテオーム解析)を行い、大腸に存在する腸内細菌Paraprevotella clara (P. clara)が腸内のトリプシン分解を促進していることを突き止めました。トリプシンは感染防御に必須なIgA抗体を分解するため、P. claraがトリプシンの分解を促進することで管腔内のIgAが維持され、経口的に侵入してきた病原体の排除につながっていることが分かりました。また、トリプシンはコロナウイルスの感染促進にも関与するため、P. claraが腸内に存在しているマウスではマウスコロナウイルス(MHV)への抵抗性を示すことも明らかになりました。実際にCOVID-19慶應ドンネルプロジェクトのサポートにより収集されたCOVID-19患者便サンプルのメタゲノム解析を行なったところ、トリプシン分解に関与するP. claraの遺伝子量が多い方は、酸素吸入が必要なく、下痢症状が軽いことが分かりました。以上のことからP. claraが腸内のトリプシン分解を促進することで、細菌やウイルスなどの病原体の感染防御に役立っていることを明らかにしました。
(微生物学・免疫学教室 本田賢也 73相当)
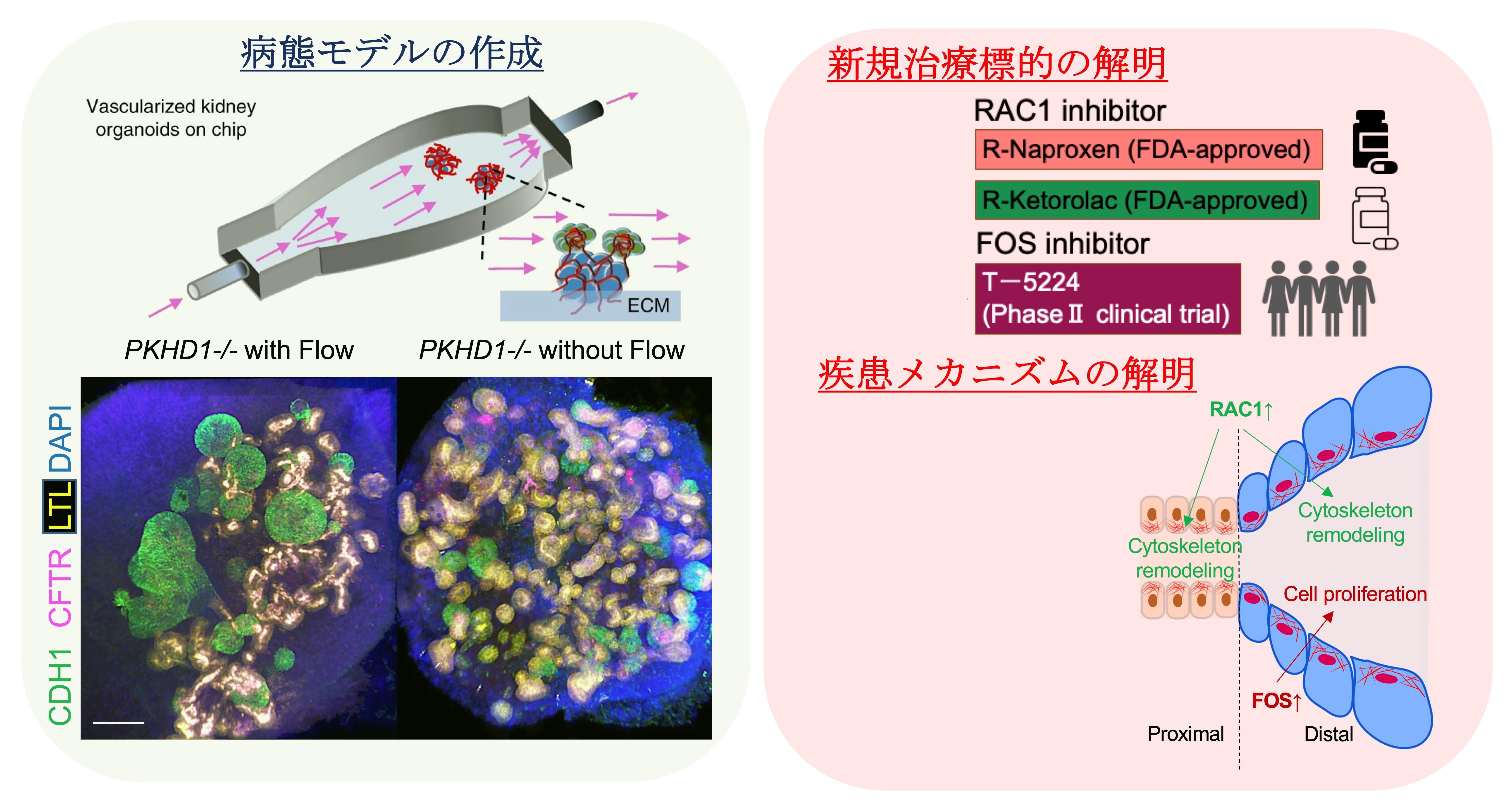
2: Organoid-on-a-chip model of human ARPKD reveals mechanosensing pathomechanisms for drug discovery.
Science Advances.
2022 Sep 23;8(38):eabq0866. doi: 10.1126
Ken Hiratsuka, Tomoya Miyoshi, Katharina T Kroll, Navin R Gupta, M Todd Valerius, Thomas Ferrante, Michifumi Yamashita, Jennifer A Lewis, Ryuji Morizane

常染色体劣性多発性嚢胞腎 (ARPKD)は、PKHD1の遺伝子変異を原因として新生児より腎臓の嚢胞形成と腎機能の低下を惹起し末期腎不全に至る遺伝性疾患である。同疾患は、これまで動物モデルで表現型を得ることが困難であり、承認された治療薬がなかった。本研究では、ヒト疾患 iPS 細胞由来及び CRISPR遺伝子編集で作成したPKHD1変異幹細胞由来の 腎臓オルガノイドを3D バイオプリンターで作成したチップ上で流動培養する (Organoid-on-a-chip)ことで、ARPKD病態モデルを作成し、尿流によるメカニカルストレスによって腎臓遠位尿細管以遠のセグメントに尿細管拡張が起こるメカニズムを解明した。また、メカノセンシングに関与する分子であるRAC1とFOSが新規治療標的となり得ること、これらを標的とし、他疾患でのFDA承認薬剤及び臨床研究に使用された薬剤が嚢胞縮小効果を持つことを示した (図)。腎臓Organoid-on-a-chipモデルは生体内微小環境を再現し、疾患の病態機序の解明と新規治療標的の発見を可能にする新規プラットフォームとなり得る。
(腎臓内分泌代謝内科 平塚 健 87回)
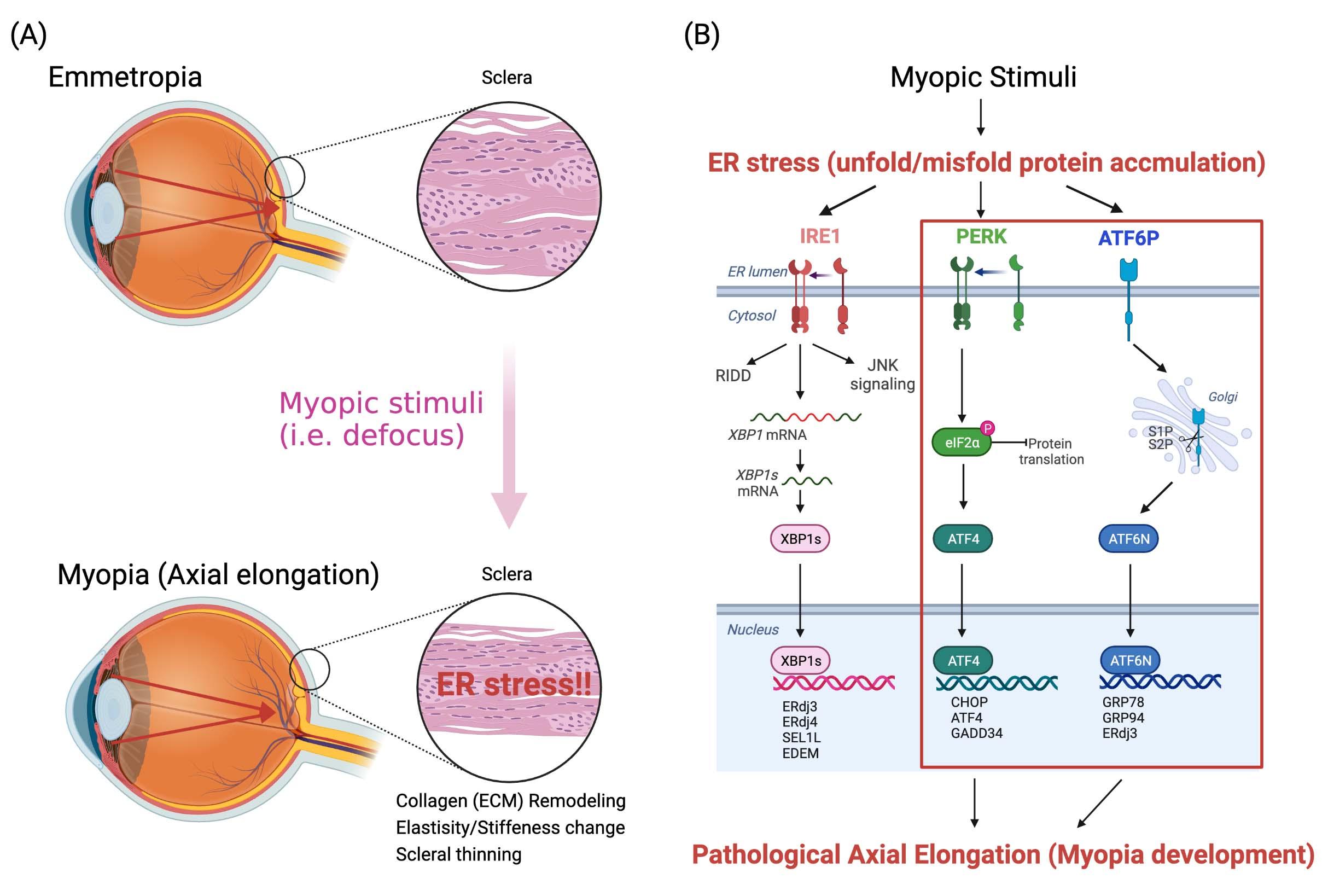
3: Scleral PERK and ATF6 as targets of myopic axial elongation of mouse eyes.
Nat Commun.
2022. doi: 10.1038/s41467-022-33605-1.
Shin-Ichi Ikeda, Toshihide Kurihara, Xiaoyan Jiang, Yukihiro Miwa, Deokho Lee, Naho Serizawa, Heonuk Jeong, Kiwako Mori, Yusaku Katada, Hiromitsu Kunimi, Nobuhiro Ozawa, Chiho Shoda, Mari Ibuki, Kazuno Negishi, Hidemasa Torii, Kazuo Tsubota

近視の病態の本質は目の前後軸の長さ(眼軸長)の伸長です。この形態変化による眼球後部への物理的負荷が視覚障害に関わることが明らかになりつつあり、近視に伴う病的な眼軸伸長の機序の解明と効果的で安全な介入法の創出が望まれていました。本研究では、近視眼では眼球の形態を維持する強膜において小胞体ストレスが生じていることを明らかにしました。強膜小胞体ストレスをフェニル酪酸などのケミカルシャペロンの投与により抑制すると病的な眼軸伸長が抑制され、この際に成長に伴う眼球の生理的眼軸伸長には影響を及ぼしませんでした。また強膜において小胞体ストレスを惹起することで近視が誘導されることも明らかになりました。さらに小胞体ストレス応答経路のうち、PERK経路とATF6経路の両経路が強膜コラーゲンの発現制御を介して眼軸伸長を制御していることを明らかにしました。この知見は病的な眼軸伸長の機序を明らかにしただけではなく、強膜小胞体ストレスへの介入によって効果的で安全に近視進行抑制が可能であることを示していることから、近視進行抑制薬開発に大きな影響を与えるものであると考えられます。
(眼科学教室 栗原俊英 80相当)
その他の掲載論文
1: A combined stem-cell-gene therapy strategy for ALS.
Nat Med.
2022 Sep;28(9):1751-1752.
Okano H.
2: Transplantation of neural progenitor cells into the human CNS.
3: Neuroendocrine neoplasms of the lung and gastrointestinal system: convergent biology and a path to better therapies.
2022 Oct 28. doi: 10.1038/s41571-022-00696-0.
Kenta Kawasaki, Natasha Rekhtman, Álvaro Quintanal-Villalonga & Charles M. Rudin
4: Longitudinal monitoring of circulating immune cell phenotypes in large vessel vasculitis.
5: AJM300 (carotegrast methyl), an oral antagonist of alpha 4-integrin, as induction therapy for patients with moderately active ulcerative colitis: a multicentre, randomised, double-blind, placebo-controlled, phase 3 study.
2022;7(7):648-657.
Matsuoka K, Watanabe M, Ohmori T, Nakajima K, Ishida T, Ishiguro Y, Kanke K, Kobayashi K, Hirai F, Watanabe K, Mizusawa H, Kishida S, Miura Y, Ohta A, Kajioka T, Hibi T.


