動けなかったマウスが歩き出す...
途切れた神経回路をつなぐ物質「CPTX」の誕生が導く未来
2021/02/08
ふと何かを思い出しているとき、ヒトの脳内では神経細胞同士がつながり合い、情報を伝達しています。手足を動かすときも、神経細胞同士が脳から脊髄を通って筋肉にまでつながる神経回路で情報のやり取りが行われています。
慶應義塾大学医学部生理学教室の柚﨑通介教授らの研究チームは、神経細胞同士のつなぎ目である「シナプス」で実際に神経細胞と神経細胞とを結び付ける物質「シナプスオーガナイザー」を世界で初めて人工的に作り出すことに成功、その研究成果を科学雑誌『Science』に発表しました。「CPTX」と名付けられたこのタンパク質を動物に投与すると、脳や脊髄でシナプスが作られます。その結果、脊髄の損傷で麻痺していたマウスの後ろ足が元通りに動くことを強力に促進し、アルツハイマー病で餌の場所を覚えられなかったマウスの記憶能力が改善するようになったのです。研究は、今後ヒトへの応用が期待されています。

シナプスは、ヒトをヒトたらしめる根源
ヒトの脳には、約1,000憶個の神経細胞があります。小さな小さな神経細胞同士はシナプスという結び目でつながり、生きた神経回路を作っています。神経回路には、目で見た視覚情報、耳で聞いた聴覚情報、身体を動かす運動機能などそれぞれに機能があり、こうした神経回路上で神経細胞同士が情報を伝え合いコミュニケーションすることで、ヒトは物事を考えたり、身体を動かしたりしています。
最新の顕微鏡技術によって、生きた動物の脳でのシナプスの様子を直接見ることが可能になっています。その結果、シナプスは生涯にわたって変化することが明らかになりました。
「赤ちゃんから大人になるまでの間、シナプスは相当な勢いで作られます。一旦作られたものがそのままの状態であるかというとそうではありません。そもそも発達期には少し作りすぎ、その中で本当に使用している必要な回路だけを残し、いらないシナプスを外していくという過程がまずあります。例えば自閉症では、回路を繋ぎ過ぎてしまうということ、減らさなくてはいけない場所で減っていないことが原因かもしれないとも言われています。」
学習や病気によって、シナプスが変化していく様子もわかってきました。
「動物に色々と学習させ、新しいことを覚えさせると、新しいシナプス結合ができていったりあるいは外れていったりするようすが観察されました。子供の間ほどの勢いではありませんが、やはり、より使う場所のシナプスは強化され、使わない場所は外されていくのです。アルツハイマー病では、神経細胞が死ぬ前にシナプスが外れていってしまうことも明らかになっています。まさにシナプスこそヒトをヒトたらしめる根源と言えるでしょう。」
シナプスのつなぎ方のバランスが崩れていくつかの精神疾患が起きることや、シナプスが外れたままつながらないことが脊髄損傷のような神経疾患になるのではないかと考えられることから、統合失調症、自閉スペクトラム症や脊髄損傷、アルツハイマー病などは『シナプス病』とも呼ばれるようになっています。
神経細胞と神経細胞をつなぐレゴブロック「シナプスオーガナイザー」
神経回路をつなぐシナプスが壊れると、岸と岸をつなぐ橋が壊れたような状態になり、神経回路はぷつぷつと断線してしまいます。
では、神経細胞同士を実際につなぐ橋の役割をしている物質とは何なのでしょうか。
研究者たちはこの物質群を「シナプスオーガナイザー」と呼び、この10数年で、シナプスオーガナイザーの研究は著しく進歩しました。その先陣を切った柚﨑教授らは、2005年にシナプスオーガナイザーのひとつである「セレベリン(Cbln1)」を発見、科学雑誌『Nature Neuroscience』に発表しています。
「Cbln1は自然に存在している分子。Cbln1を『鍵』とすれば、結合する神経細胞にはタンパク質分子でできた『鍵穴』が開いています。
シナプス前部と後部の鍵穴、そしてその間のCbln1は、ちょうどレゴブロックをはめるようにして結合するのです。」
その「鍵穴」の研究をしていた柚﨑教授らは、鍵穴の分子を司る遺伝子を無効化(ノックアウト)して「鍵穴がない状態」になったマウスと、鍵の部分であるCbln1の発現を司る遺伝子をノックアウトして「鍵がない状態」になったマウスが、同じようによたよたと歩くようになることに気付きました。
「ということは、ひょっとしたら、Cbln1がシナプス前部と後部の鍵穴に同時に結合することで、神経細胞をつなぎ合わせ、シナプスを形成していたのではないかと考えました。」
こうしてCbln1がシナプスオーガナイザーであることを突き止めた柚﨑教授らは、その構造も解明していきました。

たくさんのシナプスをつなぐタンパク質を作ろう
神経回路も電気回路も電気信号の形で情報を伝えます。しかし、電気回路では電気信号が途切れずに流れるのに対して、神経回路では、シナプスでいったん電気の流れが途絶えます。シナプス前部に電気信号が伝わると、細胞内に貯蔵していた神経伝達物質と呼ばれる化学物質が放出され、シナプス後部でそれを受け取って再び電気信号に変換されるわけです。シナプスは興奮を伝えるものと抑制を伝えるものがありますが、興奮性シナプスでは、グルタミン酸が神経伝達物質として使われ、シナプス後部にはこれを受け取るためのグルタミン酸受容体があります。面白いことに小脳の興奮性シナプスでは、シナプス前部からグルタミン酸とは別の経路で、Cbln1も放出されます。このCbln1こそが鍵となり、シナプス前部にあるニューレキシン(Nrx)、とシナプス後部にあるグルタミン酸受容体D2(GluD2)を鍵穴として、同時に結合することで、小脳シナプスの形成を強力に促進します(図1左)。
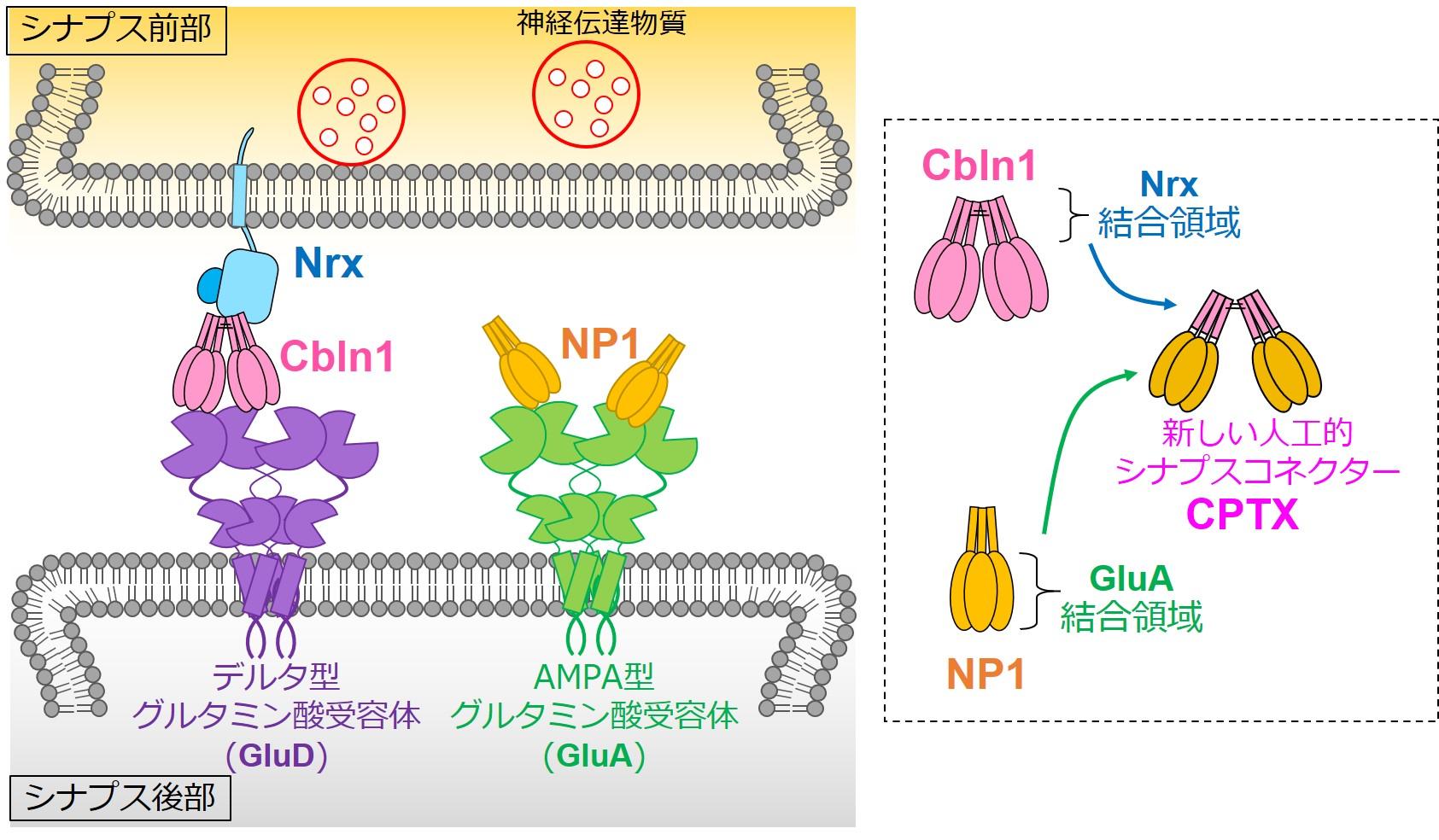
図1 シナプスオーガナイザーCbln1(左)と新しい人工シナプスコネクターCPTX(右)
「Cbln1はマウスの小脳に投与すると1-2日でシナプスを作ることができます。でもCbln1が作用するために必要な鍵穴であるGluD2は主に小脳にしかありません。そこで私たちは、脳・脊髄での興奮性シナプスのシナプス後部には必ず存在するAMPA型グルタミン酸受容体(GluA)に着目しました。」
GluAには、神経ペントラキシン(NP1)という別のシナプスオーガナイザーが結合することがわかっています。でもNP1にはシナプス前部に結合する鍵穴がありません。
「そこで、Cbln1とNP1を半分に切り、Cbln1がシナプス前部のNrxと結合する部分と、NP1がシナプス後部のGluAと結合する部分を人工的に組み合わせてやれば、全ての脳脊髄で働くシナプスコネクターができるのではないかと考えました(図1右)。こうして作り出した人工シナプスコネクターをCPTXと名付けました。」
半身不随のマウス、再び歩く!
CPTXの作用をマウスで確かめた柚﨑教授らは、あまりの効果に目を疑いました(図2)。脊髄を損傷させたマウスの脊髄にCPTXを一回だけ投与するだけで、2ヶ月に渡って後ろ足の運動機能の回復を大きく促進させたのです。これまでに開発されてきたさまざまな薬剤や治療法と比べても画期的な効果でした。
「アルツハイマー病のモデルマウスにも試しました。餌の場所を全く覚えられず、お腹がすくたび最初から餌探しでうろうろしていたマウスが、CPTXを海馬に一回投与するだけで数日後に興奮性シナプスが増加し、道順をより記憶できるようになったのです。」
小脳失調のためにうまく歩けなかったマウスは、CPTXの投与でうまく歩けるようになりました。
「まさか、こんなに効果があるとは思ってもみませんでした。まだ課題は色々とありますが、臨床試験を目指してさらに研究を深めていく予定です。」
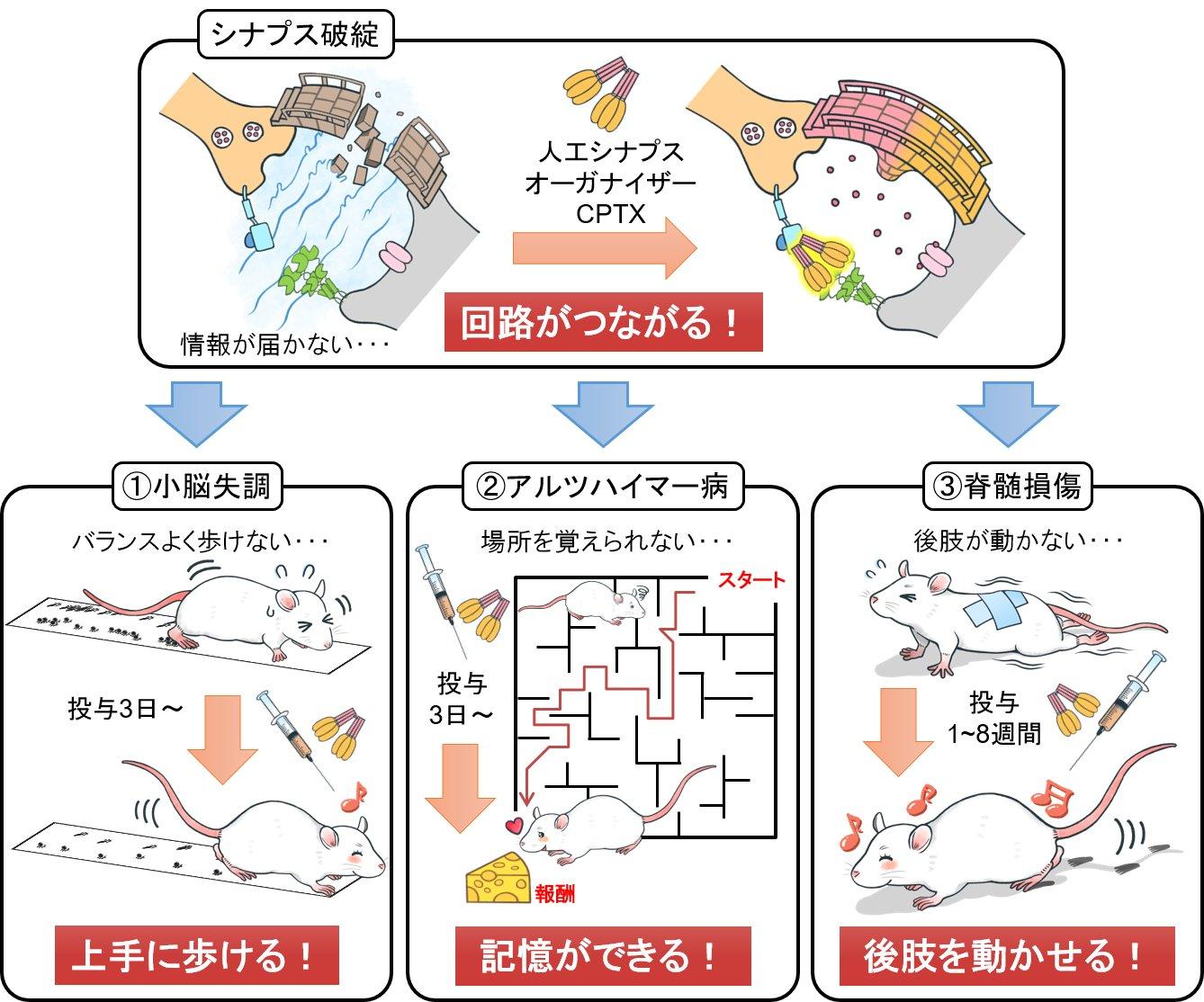
図2 マウスモデルにおけるCPTXの投与後の変化
日本・英国・ドイツの国際共同研究チーム
素晴らしい成果を上げた世界初の人工シナプスコネクターCPTXの開発では、柚﨑教授の慶應チームに愛知医科大学、北海道大学、そして英国とドイツの研究チームが参加し、国際共同研究が行われました。一般にさまざまな苦労が伴う国際共同研究ですが、柚﨑教授は実に楽しかったと語ります。
そもそも柚﨑教授は米国のセントジュード小児研究病院に研究室をもち、小脳のシナプスに豊富に存在するGluD2が一体どのように働くのかを研究していました。ある日、隣の部屋の研究者から『小脳に豊富にあるタンパク質としてCbln1が見つかっているのだけれど、どういう役割があるのか分からないから、研究しませんか』と声をかけられたことがきっかけとなり、Cbln1の研究もはじめました。
「ある日突然、今回共同研究を行ったRadu Aricescu博士(当時、英国オックスフォード大学)からE-mailをもらいました。グルタミン酸受容体の構造を知りたいので、モデルとして小脳のシナプスに多いGluD2を使いたいとのことでした。Aricescu博士とは全く面識がありませんが、当時普及し始めたばかりのビデオ会議を使ってお話ししたところ意気投合しました。」
Cbln1は、神経細胞で作られた後に、細胞の外に放出されてシナプスに蓄積します。このような関係で、細胞外で働くタンパク質についてずっと研究してきたAlexander Dityatev博士(ドイツ)と国際学会で会い、お話しするようになりました。Dityatev博士は動物モデルを用いてアルツハイマー病の研究を行っていました。
その後、柚﨑教授らは、一見全く関係がないと思われていたCbln1とGluD2が鍵と鍵穴のように小脳でのシナプスオーガナイザーとして働くことを発見し2010年にScience誌に発表しました。
「そこで、専門分野がそれぞれ異なるこの3人の力を合わせれば、何か面白いことができるのではないかと考えました。まだ3人が同時に直接会ったことはなかったのですが、Cbln1の特徴を活かした、新しい人工的なシナプスオーガナイザーを開発するというアイデアで3人は盛り上がりました。このようにして、慶應チームの研究を基盤に日・独・英の国際共同研究が始まりました。」
どのチームが欠けてもここまで進めることはできなかったと柚﨑教授は言います。
「研究室の新人歓迎会では、毎年、『We are in the same boat』と話していますが、私たち研究者の究極の目標は、研究成果を社会に還元し、人類の福祉や文化に貢献することだと考えています。つまり、みな同じ船の乗組員。今回、海外勢では、タンパク質の結晶構造の解明は英国チームが、アルツハイマー病関連のパートはドイツチームが実力を発揮してくれました。Cbln1を元にこの3国チームで研究を進めることができ、本当に楽しかったです。」
CPTXは長く役立つものになるか-ヒトへの応用に期待
研究は、面白いからやっているという要素こそが、最大の推進力ではないか―。脳科学の面白さを若い世代にも伝えたいという思いから、柚﨑教授はNPO脳の世紀推進会議の活動の一環として、高校生向けに塾内の脳関係研究室の見学会開催や、脳科学オリンピック(中・高校生出場)にも携わってきました。
「慶應義塾大学の塾長を務められた小泉信三先生は、学問について『すぐに役に立つものは、すぐに役に立たなくなるものである』ということを常日頃おっしゃっていました。目の前の治療ばかり考えすぎてしまうと、発想はそこからあまり広がりません。若い人たちには大いに好奇心をもって研究し、その先でどこかの病気につながればよいぐらいに思ってほしい。患者さんにすぐに役立ちそうな研究はもちろん重要ですが、長く役立つものを生み出すには、基礎研究からきっちり行うことがとても大切だと考えています。」
CPTXはもともとヒトの脳にあるシナプスオーガナイザーを改変して作製されたもので、ヒトへの投与でマウスと同じような効果が得られる可能性が考えられています。
「まずはCPTXを薬として使えるようにしたいですね。」
今後は安全性の問題など、またさまざまなハードルを乗り越え臨床試験を目指す柚﨑教授ら。
不可能と思われていた医学の難題が、またひとつ解き明かされつつあります。
1985年自治医科大学医学部卒業、ECFMG(米国海外医学部卒業認定資格)も取得。1993年自治医科大学大学院 博士取得後、米国ロッシュ分子生物学研究所・HFSP長期海外研究員。1995年米国セントジュード小児研究病院・助教授、2002年同准教授。2003年より慶應義塾大学医学部生理学教授、現在に至る。2020年より日本神経科学学会会長。


