

学位
| 1988年 | 医師免許 |
|---|---|
| 1994年 | 医学博士 |
主な研究領域
略歴
| 1988年3月 | 慶應義塾大学医学部卒業 |
|---|---|
| 1988年4月 | 慶應義塾大学大学院医学研究科入学 |
| 1992年3月 | 慶應義塾大学大学院医学研究科博士課程 所定単位取得退学 |
| 1992年4月 | 慶應義塾大学医学部内科学(助手) |
| 1994年2月 | 慶應義塾大学 博士(医学)取得 |
| 1995年9月 | ハーバード大学Beth Israel Medical Center (リサーチフェロー) |
| 2000年8月 | 東京医科歯科大学医学部消化器内科学(助手; 2004年より講師) |
| 2008年4月 | 慶應義塾大学医学部消化器内科(准教授) |
| 2013年8月 | 慶應義塾大学医学部消化器内科(教授) |
| 2014年4月 | AMED(難治性疾患実用化研究事業; 統括班長) |
| 2014年10月 | 慶應義塾大学病院免疫統括医療センター(センター長) |
| 2016年4月 | 慶應義塾大学病院IBDセンター (センター長、兼任) |
| 2016年10月 | AMED-CREST(主任研究者) |
| 2017年10月 | 慶應義塾大学医学部学部長補佐(兼任) |
| 2018年7月 | 慶應義塾大学病院消化器センター (センター長、兼任) |
| 2019年10月 | 慶應義塾大学医学部総合医科学研究センター(副センター長、兼任) |
| 2020年 5月 | コロナ制圧タスクフォース研究統括責任者 |
受賞・特許
| 2008年 | 慶應義塾大学医学部三四会 北島賞 |
|---|---|
| 2020年12月 | 日本免疫学会ヒト免疫研究賞 |
| 2021年4月 | 日本消化器病学会学術賞 |
研究内容
1. 消化管における腸内細菌叢と粘膜免疫の相互作用の解明
消化管は、栄養や水分の吸収に加えて、最大の免疫細胞の貯蔵庫としての側面を持つ。我々は、一貫して炎症性腸疾患の病態において、腸管免疫の機能解析を行ってきた。ヒト腸管において、CD25陽性細胞が炎症抑制能を持つTreg細胞であることを明らかとした(Makita S, 2004)。Treg細胞は、マウス大腸炎に置いてTh17細胞がTh1細胞に脱分化し、腸炎惹起能の獲得を抑制すること(Sujino T, 2011)、Clostridium属のプロバイオティクス製剤によりTreg細胞およびIL-10産生性マクロファージが誘導されること(Kasiwagi I, 2015; Hayashi A, 2013)を明らかにした。また、lymphotoxin (LT)α欠損マウスでTh17細胞が減少する一方で、 IL-17産生性のILC3がパラドキシカルに増加すること(Ono Y, 2012)、ヒトILC3がIL-23刺激下でIL-22を賛成し、腸管上皮修復機構を要すること(Mizuno S, 2014)を明らかとした。さらに、腸内細菌叢の乱れ、すなわちディスバイオーシスにより、皮膚(Hayashi A, 2017: Kiyohara H, 2019)、肝臓(Nakamoto N, 2017, 2019; Taniki N, 2018)に変化が起こり、炎症性腸疾患に併発する腸管外合併症の発症機序の一端を明らかとした。
2. 肝臓と消化管を結ぶ腸肝相関を介した自己免疫性肝疾患の病態解明
腸肝相間の観点から、免疫難病である原発性硬化性胆管炎(Primary sclerosing cholangitis: PSC)をはじめとする自己免疫性肝疾患の病態解明を行っている。PSC患者の便を無菌マウスに移植したヒトフローラ化マウスを用いて、腸間膜リンパ節に“侵入”したbacterial translocation菌を分離培養することに成功し、宿主侵入性かつ自己免疫誘導能が高い疾患特異的腸内細菌をスクリーニングする手法を樹立した。本手法を用いて、大腸上皮の障害能を有するKlebsiella pneumoniae (KP) (図1)がPSC患者便中に高率に存在すること、KPをはじめとするbacterial translocation誘導菌による肝臓内免疫応答を介した胆管障害の発症機序を明らかにした。現在、種々の肝臓疾患への腸内細菌の関与を検討するとともに、海外の企業との共同研究として、PSCに対する病因菌を標的としたバクテリオファージを用いた臨床応用を目指している。
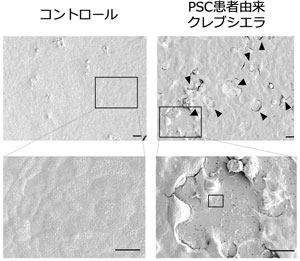
図1 PSC患者より分離したクレブシエラは大腸上皮障害能を有する
3. 自律神経系を介した「肝-脳-腸相関」を介した腸管免疫制御機構の解明
自律神経系を介した腸管の運動、免疫、嗜好性の制御機構の検討を行っている。炎症性腸疾患(IBD)は、過敏性腸症候群(IBS)やうつ病などの中枢神経(脳)や末梢神経(腸管)が病態に関与すると考えらえれる疾患と相関することは臨床的にはよく知られているが、その病態のオーバーラップに関して不明な点が多かった。我々は、腸管に張り巡らされている自律神経系が、抗原提示細胞(APC)と共局在し(Fig.3)、ムスカリン型アセチルコリン受容体(mAChR)を介してAPCを刺激、さらには制御性T細胞(pTreg)の分化・維持に極めて重要な働きをすることが明らかとした。さらに、神経のトレーシング技術および迷走神経切除モデル動物を用いて、この現象は、肝臓から脳への迷走神経求心路、脳から腸管への迷走神経遠心路を介していることを発見した(Teratani T, 2020)。
これらの知見を生かし、自律神経系が、腸管における粘膜免疫、蠕動運動、ホルモン産生、そして、中枢神経系の高次脳機能への影響を検討している。
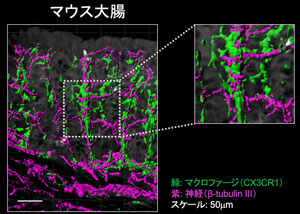
図2 マウス大腸において自律神経とAPCは共局在している
代表論文
- COVID-19 Host Genetics Initiative.
Mapping the human genetic architecture of COVID-19.Nature. 2021 Jul 8. doi: 10.1038/s41586-021-03767-x. - Sugimoto S, Kobayashi E, Fujii M, Ohta Y, Arai K, Matano M, Ishikawa K, Miyamoto K, Toshimitsu K, Takahashi S, Nanki K, Hakamata Y, Kanai T, Sato T. An organoid-based organ-repurposing approach to treat short bowel syndrome. Nature. 2021 Apr;592(7852):99-104.
- Teratani T, Mikami Y, Nakamoto N, Suzuki T, Harada Y, Okabayashi K, Hagihara Y, Taniki N, Kohno K, Sibata S, Miyamoto K, Ishigame H, Chu PS, Sujino T, Suda W, Hattori M, Matsui M, Okada T, Okano H, Inoue M, Yada T, Kitagawa Y, Yoshimura A, Tanida M, Tsuda M, Iwasaki Y, Kanai T. The liver-brain-gut neural arc maintains the Treg cell niche in the gut. Nature. 2020 Jun 11. doi: 10.1038/s41586-020-2425-3.
- Nanki K, Fujii M,Shimokawa M, Matano M, Nishikori S, Date S, Takano A, Toshimitsu K, Ohta Y, Takahashi S, Sugimoto S, Ishimaru K, Kawasaki K, Nagai Y, Ishii R, Yoshida K, Sasaki N, Hibi T, Ishihara S, Kanai T, Sato T. Somatic inflammatory gene mutations in human ulcerative colitis epithelium. Nature. 2020;577:254-259.
- Saito Y, Koya J, Araki M, Kogure Y, Shingaki S, Tabata M, McClure MB, Yoshifuji K, Matsumoto S, Isaka Y, Tanaka H, Kanai T, Miyano S, Shiraishi Y, Okuno Y, Kataoka K.Landscape and function of multiple mutations within individual oncogenes. Nature. 2020 Jun;582(7810):95-99. doi: 10.1038/s41586-020-2175-2. Epub 2020 Apr 8.
- Koda Y, Nakamoto N, Chu PS, Ugamura A, Mikami Y, Teratani T, Tsujikawa H, Shiba S, Taniki N, Sujino T, Miyamoto K, Suzuki T, Yamaguchi A, Morikawa R, Sato K, Sakamoto M, Yoshimoto T, Kanai T. Plasmacytoid dendritic cells protect against immune-mediated acute liver injury via IL-35. J Clin Invest. 2019 Jul 2;129(8):3201-3213. doi: 10.1172/JCI125863. eCollection 2019 Jul 2. PMID: 31264967
- Nakamoto N, Sasaki N, Aoki R, Miyamoto K, Suda W, Teratani T, Suzuki T, Koda Y, Chu PS, Taniki N, Yamaguchi A, Kanamori M, Kamada N, Hattori M, Ashida H, Sakamoto M, Atarashi K, Narushima S, Yoshimura A, Honda K, Sato T, Kanai T. Gut pathobionts underlie intestinal barrier dysfunction and liver T helper 17 cell immune response in primary sclerosing cholangitis. Nature Microbiol. 2019 Mar;4(3):492-503. doi: 10.1038/s41564-018-0333-1. Epub 2019 Jan 14. PMID: 30643240
- Teratani T, Tomita K, Suzuki T, Furuhashi H, Irie R, Nishikawa M, Yamamoto J, Hibi T, Miura S, Minamino T, Oike Y, Hokari R, Kanai T. Aortic carboxypeptidase-like protein, a WNT ligand, exacerbates nonalcoholic steatohepatitis. J Clin Invest. 2018 Apr 2;128(4):1581-1596. doi: 10.1172/JCI92863. Epub 2018 Mar 19.PMID:
論文指導資格の有無
修士、博士


