- ホーム
- 拠点リーダーからのご挨拶
- 幹細胞医学とは
- 幹細胞医学教育研究センター
- 5つの領域・サブグループ
- 事業推進担当者一覧
- 若手研究者情報
- COEX MEETING
- プレスリリース(抜粋)/発表論文情報
- KORD[研究者成果登録]
プログラム終了に当たって

中島秀明 (なかじまひであき)

慶應義塾大学医学部 血液内科 准教授
Hideaki Nakajima, MD, PhD
hnakajim@sc.itc.keio.ac.jp
http://www.keio-hematology.jp/
GCOE研究テーマ(役割分担)と研究計画
「造血幹細胞の未分化状態と血球分化の制御法開発および細胞医療への応用」
血液細胞の分化は、多分化能および自己複製能をもつ造血幹細胞(HSC)を頂点とし、多段階の運命決定を経て特定の血球系列(白血球・赤血球・血小板など)へ変化してゆく一連の過程である。HSCは骨髄中のニッチとよばれる微小環境に存在し、ニッチの様々なシグナルにより未分化状態に保たれている。血球産生の需要が高まるとHSCはニッチから動員され、分化・増殖し各種血球産生を行う。その後の血球分化にはC/EBPα, GATA-1などさまざまな転写因子が重要な役割を果たしており、これらにより各分化段階での運命決定がなされる。このような分化過程は従来不可逆的と考えられてきたが、我々の研究で分化形質は必ずしも絶対的なものではなく、可塑性を有することが明らかとなってきた。本研究では、HSCの未分化性維持から成熟血球分化に至る一連の生理的プログラムを転写因子やニッチ因子を制御することで人為的に操作し、1)血球のリプログラミングによる多能性血球前駆細胞の創出、2)HSCの体外増幅、を行うことを目標にしている。これにより造血幹細胞移植や輸血医療に応用可能な臨床グレードの新たな細胞ソースを作り出すことを目指している。
略歴
昭和62年3月 |
慶應義塾大学医学部医学科卒業 |
昭和62年4月 |
慶應義塾大学医学部 内科学教室、研修医 |
平成3年6月 |
慶應義塾大学医学部 内科学教室(血液)、助手 |
平成7年7月 |
米国St. Jude Children's Research Hospital, Department of Biochemistry, Postdoctoral Fellow |
平成11年4月 |
慶應義塾大学医学部 輸血細胞療法部、助手 |
平成13年7月 |
東京大学医科学研究所造血因子探索研究部、助手 |
平成13年12月 |
東京大学医科学研究所先端医療研究センター 細胞療法分野、助手 |
平成16年7月 |
東京大学医科学研究所 研究拠点形成、特任准教授 |
平成20年2月 |
慶應義塾大学医学部 内科学教室(血液)、専任講師 |
平成22年2月 |
慶應義塾大学医学部 血液内科、准教授 |
主たる研究領域
血液腫瘍学
幹細胞生物学
血球分化の分子メカニズム
主たる所属学会
日本内科学会
日本血液学会(代議員)
日本癌学会
Member, American Society of Hematology (ASH)
賞罰
平成10年12月 |
ASH Merit Award (Annual Meeting of American Society of Hematology) |
平成13年4月 |
日本血液学会奨励賞 |
平成21年1月 |
坂口光洋記念慶應義塾医学振興基金 慶應医学賞医学研究奨励賞 |
研究協力者
福地 由美(血液内科)
定平 健(G-COE RA)
黒田 佳奈(東京大学医科学研究所)
岡本 真一郎(内科学)
須田 年生(発生・分化生物学)
北村 俊雄(東京大学医科学研究所)
宮脇 敦史(理化学研究所)
岩間 厚志(千葉大学)
森川 吉博(和歌山医科大学)
高橋 智(筑波大学)
Daniel Tenen (Harvard Univ.)
Lothar Hennighausen (NIH)
これまでの研究成果
我々は血球転写因子による血球分化制御機構の解明に一貫して取り組んでおり、特にC/EBP, PU.1ファミリー転写因子による骨髄系分化誘導メカニズムを中心に研究を進めている。この中で、骨髄系転写因子であるC/EBPαをリンパ系・赤芽球系などの細胞で異所性に発現させるとこれらの細胞が骨髄系にリプログラミングされることを世界に先駆けて報告し、成熟血球が分化の可塑性を保持していることを明らかにした。また系列特異的と考えられてきたこれら転写因子が造血幹細胞でも機能しており、自己複製能を負に制御していることも報告している。骨髄ニッチによる造血幹細胞制御機構の研究では、細胞外マトリックス制御因子であるTIMP-3が造血幹細胞の自己複製と静止状態維持を制御しており、骨髄抑制時における造血幹細胞の細胞周期動員と血球回復に重要な役割を果たしていることを明らかにした。
1.骨髄微小環境による造血幹細胞の自己複製・細胞周期制御メカニズム
造血幹細胞(hamatopoietic stem cell: HSC)は、成体骨髄中にごくわずか存在し、自己複製を行うとともにすべての血液細胞に分化する能力(多分化能)を持った細胞である。HSCは骨髄中のnicheとよばれる微小環境に存在し、ここでHSCは細胞周期の静止期(G0期)に保たれ、ゆっくりと自己複製を行っている。このように静止期にある造血幹細胞は、ひとたび血球産生の需要が高まるとnicheから動員されて細胞周期に入り、各種の血球産生を行う。HSCの自己複製・増殖・分化を調節するサイトカイン・増殖因子には、Angiopoietin-1 (Ang-1), Wnt, Thrombopoietin (TPO), BMP4, Sonic Hedgehogなどがある。このような液性因子は造血幹細胞nicheを構成する骨芽細胞などの骨髄ストローマ細胞から産生され、nicheという極めて局所的かつ微細な環境下でHSCに作用している。このような微小環境下では、細胞をとりまく様々な細胞外マトリックスがこのような幹細胞シグナルに影響を与え、さらにはこれらを積極的に制御していると予想される。
我々の研究室ではこのような幹細胞nicheに焦点をあて、これがいかにHSCの自己複製と細胞周期を制御しているかを明らかにしようとしている。この中でimmune suppressor factor (ISF)とよばれる細胞膜分子が骨髄間質細胞株のHSC支持能を増強させることを報告し、さらにその過程で細胞外マトリックスの修飾に重要なmatrix metalloproteinase-3 (MMP-3)およびtissue inhibitor of metalloproteinase (TIMP)-3がHSCの未分化性維持に深く関与していることを見いだした。特にTIMP-3は、骨髄抑制時に骨髄中の発現が増強し、静止状態にあるHSCを細胞周期に入れて血球前駆細胞の産生を亢進させる役割を果たしていることを見いだした。
以上のことは細胞外マトリックスの修飾がHSCの生理動態に重要な役割を果たしていることを示しており、これらを人為的に調節してやることでHSCの自己複製・分化の人為的制御が可能になることが期待される。将来的には、これを応用してHSCの体外増幅やHSC分化制御による血球産生コントロール法の開発につなげたいと考えている。
2.血球系転写因子の異常と白血病発病の分子メカニズム
白血病は、造血幹細胞/前駆細胞などの未熟な血液細胞がさまざまな遺伝子変異により腫瘍化して発症する。その発症原因となる遺伝子変異は様々であるが、それらのいずれにも共通しているのは、白血病幹細胞(leukemic stem cell; LSC)と呼ばれるごく少数の細胞が存在し、これらの細胞により白血病が発症・維持されていることである。LSCは正常の造血幹細胞(hematopoietic stem cell; HSC)と同様自己複製能を持ち、分裂に際して自らと全く同じ細胞を複製することで白血病状態を維持している。また白血病細胞では、正常な細胞分化が障害され、同時に制御不能な増殖能を獲得している。現在まで同定されている様々な白血病原因遺伝子(染色体転座遺伝子、癌遺伝子/癌抑制遺伝子の変異、など)がいかにしてLSCの生成に関与しているのか、また白血病細胞の分化がいかにして障害され増殖が亢進しているのか、その分子メカニズムには不明が多い。
血球特異的転写因子であるC/EBPαおよびPU.1は、骨髄系細胞分化に大変重要な働きをしており、これらの機能が抑制されると細胞分化の停止を招くことが知られている。さらに我々は、C/EBPαおよびPU.1が細胞分化だけではなく、正常HSCの自己複製に深く関与していることを見いだした。C/EBPαおよびPU.1は非常に多くの白血病原因遺伝子の標的となっているため、我々はこれらの異常が血液細胞の分化や自己複製の異常へとつながり、白血病発症の鍵になっていると考えている。我々は白血病発症をC/EBPα, PU.1を含む様々な血球転写因子の異常ととらえ、AML1関連白血病、MLL関連白血病などにおいて、どのような転写因子の機能が障害されているのかを、マウスの白血病モデル、遺伝子改変マウスなどを用いて精力的に解析している。これらの研究成果をもとに、白血病幹細胞を標的にした新たな治療薬を開発し、将来的な白血病治療成績の向上につなげたいと考えている。
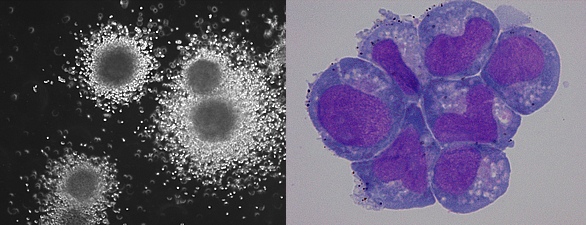
図1:MLL融合遺伝子により形質転換したマウス白血病細胞
3.血球特異的転写因子による血球のリプログラミング
血液細胞の分化は、多分化能および自己複製能をもつ造血幹細胞(hamatopoietic stem cell: HSC)を頂点とし、多段階の運命決定を経て特定の血球系列(白血球・赤血球・血小板など)へと変化してゆく一連の過程である。このような血球分化の運命決定には、C/EBPα, Ikaros, GATA-1, NF-E2などさまざまな血球特異的転写因子が重要な役割を果たしており、これらが失われると対応する血球系列への分化が障害される。このような血球分化の過程は従来不可逆的であると考えられ、一度ある血球系列へ分化した細胞は未熟な細胞へ逆戻り(脱分化)したり、あるいは他の血球に変化したりするようなことは決してないと考えられてきた。しかし我々のグループは、血球転写因子を本来の系列以外に異所性に発現させると分化の方向を人為的に変化させることが可能であることを見いだした。たとえば、骨髄系特異的転写因子であるC/EBPαをリンパ球や赤芽球系細胞に発現させると、これらの細胞は好中球やマクロファージに変化する。これらのことは、ある程度分化した細胞でも潜在的多分化能(latent multipotentiality)を保持しており、転写因子機能を制御することでリンパ球などの成熟血球をリプログラミングし系列転換させることが可能であることを示している。最近世界の注目を集めている体細胞の万能細胞(iPS細胞)へのリプログラミングも、たった4つの転写因子によりなされており、このことからも転写因子の制御によって細胞の分化状態を変化させることが可能であることは明白である。
我々は現在これらの技術を応用し、成熟血球のリプログラミングにより多能性血球前駆細胞の作成を目指して研究を進めている。
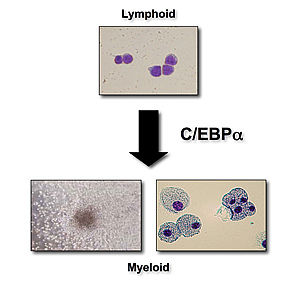
図2:C/EBPαによるリンパ系前駆細胞の骨髄系への転換
G-COE内共同研究
造血幹細胞の未分化性維持機構の解明(慶應義塾大学(坂口光洋記念講座)発生・分化生物学教室)
代表論文
- Shibata F, Goto-Koshino Y, Morikawa Y, Komori T, Ito M, Fukuchi Y, Hauchins JP, Tsang M, Kitamura T, Nakajima H: Robo4 is expressed on hematopoietic stem cells and potentially involved in the niche-mediated regulation of the side population phenotype. Stem cells 27: 183-190, 2009.
- Nakajima H, Ito M, Morikawa Y, Komori T, Fukuchi Y, Shibata F, Okamoto S, Kitamura T: Wnt modulators, SFRP-1 and SFRP-2 are expressed in osteoblasts and differentially regulate hematopoietic stem cells. Biochem Biophys Res Commun., 390:65-70, 2009.
- Nakajima H, Tamura T, Ito M, Shibata F, Kuroda K, Fukuchi Y, Watanabe N, Kitamura T, Ikeda Y, Handa M: SHD1 is a novel cytokine-inducible, negative feedback regulator of STAT5-dependent transcription. Blood 113:1027-36, 2009.
- Fukuchi Y, Ito M, Shibata F, Kitamura T, Nakajima H: Activation of C/EBPα or PU.1 in hematopoietic stem cells leads to their reduced self-renewal and proliferation. Stem cells 26:3172-88, 2008.
- Watanabe-Okochi N, Kitaura J, Ono R, Harada H, Harada Y, Komeno Y, Nakajima H, Nosaka T, Inaba T, Kitamura T: AML1 mutations induced MDS and MDS/overt leukemia in mouse BMT model. Blood, 11:4297-308, 2008.
- Fukuchi Y, Shibata F, Ito M, Goto-Koshino Y, Sotomaru Y, Ito M, Kitamura T, Nakajima H: Comprehensive analysis of myeloid lineage conversion using mice expressing an inducible form of C/EBPα. EMBO J. 25:3398-3410, 2006.
- Nakajima H, Watanabe N, Shibata F, Kitamura T, Ikeda Y, Handa M: N-terminal region of CCAAT/ enhancer binding protein ε is critical for cell cycle arrest, apoptosis and functional maturation during myeloid differentiation. J Biol Chem. 281:14494-14502, 2006.
- Nakajima H, Shibata F, Fukuchi Y, Goto-Koshino Y, Ito M, Urano A, Nakahata T, Aburatani H, Kitamura T: Immune suppressor factor confers stromal cell line with enhanced supporting activity for hematopoietic stem cells. Biochem Biophys Res Commun. 340:35-42, 2006.
- Ono R, Nakajima H, Ozaki K, Kumagai H, Kawashima T, Taki T, Kitamura T, Hayashi Y, Nosaka T: Dimerization of MLL fusion proteins and FLT3 activation synergize to induce multiple-lineage leukemogenesis. J Clin Invest. 115:919-929, 2005.
- Fukuchi Y, Nakajima H, Sugiyama D, Hirose I, Kitamura T, Tsuji K: Human placenta-derived cells have mesenchymal stem/progenitor cell potential. Stem Cells. 22:649-58, 2004.
- Nakajima H, Ihle JN: Granulocyte colony stimulating factor regulates myeloid differentiation through CCAAT-enhancer binding protein ε. Blood 98: 897-905, 2001.
Copyright © Keio University. All rights reserved.
