- ホーム
- 拠点リーダーからのご挨拶
- 幹細胞医学とは
- 幹細胞医学教育研究センター
- 5つの領域・サブグループ
- 事業推進担当者一覧
- 若手研究者情報
- COEX MEETING
- プレスリリース(抜粋)/発表論文情報
- KORD[研究者成果登録]
プログラム終了に当たって

松尾光一 (まつおこういち)

慶應義塾大学大学院医学研究科 共同利用研究室/慶應医科学開放型研究所 教授
Koichi Matsuo, MD, PhD
matsuo@sc.itc.keio.ac.jp
http://www.matsuo-lab.com
GCOE研究テーマ(役割分担)と研究計画
実現可能な再生医療の実践
「骨組織の分化・維持・修復における細胞間相互作用」
骨組織は実用化にもっとも近い再生医療標的のひとつであり、幹細胞を試験管内で骨芽細胞へ分化させることも可能である。しかし、医療応用のためには、骨吸収と骨形成からなる「骨リモデリング」や、発生や骨折治癒での「内軟骨性骨化」の機構解明が必須である。これらの過程は、細胞間相互作用に基づいて調節されている。本プログラムでは、破骨細胞や骨芽細胞、骨細胞、軟骨細胞を中心に、血管内皮細胞、神経細胞なども含めた細胞間相互作用を解明し再生医療への貢献を目指す。
「骨リモデリング」では細胞表面のリガンドephrinとレセプターEphを介した両方向性シグナルを解析する。破骨細胞に発現するehrinB2と骨芽細胞のEphB4の相互作用は骨吸収から骨形成への移行を制御していると考えられるが、今回、Bクラスとは異なるAクラスのephrinA-EphAの骨リモデリングにおける役割を解明する。また、骨折治癒モデルを用いて骨修復過程の「内軟骨性骨化」における炎症性細胞と軟骨前駆細胞との相互作用を解析する。特に、内軟骨性骨化において、骨芽細胞が極性を獲得して骨形成を行い、軟骨を置換する機構を分子形態学的に解明する。
略歴
1986年3月 |
慶應義塾大学医学部卒業 |
1990年3月 |
慶應義塾大学大学院医学研究科博士課程修了 |
1990年4月 |
慶應義塾大学医学部助手 |
1992年9月 |
スイス チューリッヒ大学に留学 |
1995年4月 |
オーストリア 分子病理学研究所(IMP)に留学 |
1998年11月 |
オーストリア 分子病理学研究所(IMP)スタッフ研究員 |
2001年4月 |
国立療養所中部病院長寿医療研究センター室長(老年病研究部) |
2002年4月 |
慶應義塾大学医学部助教授(微生物学・免疫学教室) |
2009年6月 |
慶應義塾大学医学部共同利用研究室/慶應医科学開放型研究所 教授 |
研究分野
骨免疫学 (osteoimmunology)
免疫系が密接に関わっていることは,慢性関節リウマチでの骨破壊の病像などから知られている.分子レベルでも,例えば破骨細胞分化に必須なサイトカインRANKLは骨芽細胞だけでなく活性化T細胞にも発現しているし,RANKL欠損マウスでは,破骨細胞が分化しないだけでなくリンパ節が形成されない.また,抗ウイルス作用をもつインターフェロンβは,破骨細胞前駆細胞から分泌され破骨細胞への分化を抑制する.このように,骨形成や骨吸収を調節する分子機構が,免疫系と緊密に関連していることが注目され,骨免疫学という新領域が成立した.
われわれは,骨を吸収する破骨細胞が,微生物を貪食するマクロファージと共通の前駆細胞から分化することに着目した.転写因子AP -1のサブユニットであるFosを欠損する遺伝子改変マウス(Fosノックアウトマウス)では,マクロファージは分化するが破骨細胞が全く分化しないため大理石骨病になる.破骨細胞分化にFosが必須であることを利用し,転写因子Fosの発現調節を受けている標的遺伝子群を探索したところ,破骨細胞分化・機能の重要な制御因子がいくつか見つかってきている.一方,Fos欠損マウスのマクロファージは正常な貪食能を持っていると考えられているが,マクロファージへの分化におけるAP-1の役割には不明な点が多い.一般に,マクロファージは自然免疫において重要な働きをしていると考えられているが、そのサイトカイン産生や殺菌作用にも不明な点が多い。現在われわれは途上国、先進国を問わず食中毒症を起こしているサルモネラ(Salmonella typhimurium)と遺伝子変異マウスを用いた実験モデルによってマクロファージのリポ多糖体に対する応答,貪食機構とそれに続く殺菌機構、またサルモネラのマクロファージ内における殺菌耐性機構を,菌側とマクロファージ側のそれぞれの遺伝子発現制御に焦点を当てて解析している。
受賞・特許
- 特願2006-309602 炎症性疾患の検出並びに炎症性疾患の予防又は治療用組成物
丸山健太、松尾光一、保田尚孝
学校法人慶應義塾 オリエンタル酵母工業株式会社
平成18年5月12日出願
その他・キーワード等
骨免疫学,転写因子AP-1,骨芽細胞,破骨細胞,マクロファージ,ノックアウトマウス,サルモネラ
研究協力者
佐野元市郎(COE PD)
入江奈緒子(COE RA)
ニーランジャン・レイ(New York University)
佐々木由里(COE 研究員)
後藤真一(シャープ株式会社)
渡邊慶彦(北里大学)
西脇徹(済生会宇都宮病院 整形外科)
山口徹(整形外科教室)
チェン・ザオ(Duke University Medical Center)
高田康成(微生物学・免疫学教室)
これまでの研究成果
破骨細胞と骨芽細胞は細胞間接触や拡散性因子などのさまざまな手段で相互に制御しあっている(Fig.1)。われわれは破骨細胞分化のおこる「開始期」、骨吸収から骨形成への「移行期」、骨形成が完了する「終了期」に分けて破骨細胞と骨芽細胞の細胞間相互作用を捉えた(1)。さらに、分化過程で破骨細胞にephrinB2の発現が誘導されることを見出し、破骨細胞上のephrinB2と骨芽細胞上のEphB4の相互作用により破骨細胞の分化抑制と骨芽細胞の分化促進がおこることを、マウスをもちいた実験で示した (2)。すなわち骨リモデリングにおいて、ephrinB2-EphB4の相互作用が骨吸収から骨形成への移行を促進し「カップリンファクター」として働き得るというモデルを提唱した(Fig.2)。また、マウスの耳小骨をもちいて骨リモデリング制御を解析した(3,4)。
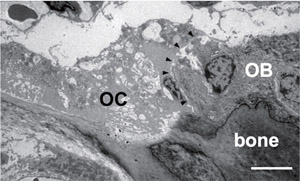
Fig.1 Osteoclast-osteoblas interaction. Transmission electronmicroscopic image of the mouse tibia shows an osteoclast(OC) in direct contact with an adjacent osteoblast(OB) on the bone surface.
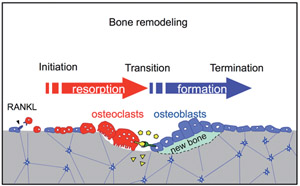
Fig.2 Bone remodeling and coupling factors. EphrinB2 and EphB4 are transmembrane proteins. Diffusible paracrine factors and molecules released from the bone matrix can also function as coupling factors(shown in yellow) balancing bone resorption and bone formation.
COE内共同研究
- 微生物学・免疫学×発生分化生物学講座;エフリンとエフによる骨リモデリング制御
- 微生物学・免疫学×整形外科; 転写因子Fra1による頭蓋骨形態異常
- 微生物学・免疫学×整形外科; 骨折治癒過程におけるFra1を介した炎症制御機構
代表論文
- Matsuo K., Irie N. Osteoclast-osteoblast communication. Arch. Biochem. Biophys. 473: 201-209, 2008.
- Zhao C., Irie N., Takada Y., Shimoda K., Miyamoto T., Nishiwaki T., Suda T., Matsuo, K. Bidirectional ephrinB2-EphB4 signaling controls bone homeostasis. Cell Metab. 4: 111-121, 2006.
- Kanzaki, S., Ito, M., Takada, Y., Ogawa, K., Matsuo, K. Resorption of auditory ossicles and hearing loss in mice lacking osteoprotegerin. Bone 39: 414-419, 2006.
- Kanzaki, S., Takada, Y., Ogawa, K., Matsuo, K. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin. J. Bone Miner. Res. 24: 43-49, 2009.
- Matsuo, K. Cross-talk among bone cells. Curr. Opin. Nephrol.Hypertens. in press, 2009.
Copyright © Keio University. All rights reserved.
