- ホーム
- 拠点リーダーからのご挨拶
- 幹細胞医学とは
- 幹細胞医学教育研究センター
- 5つの領域・サブグループ
- 事業推進担当者一覧
- 若手研究者情報
- COEX MEETING
- プレスリリース(抜粋)/発表論文情報
- KORD[研究者成果登録]
プログラム終了に当たって

須田年生 (すだとしお)

慶應義塾大学大学院医学研究科 発生・分化生物学 教授
Toshio Suda, MD, PhD
sudato@sc.itc.keio.ac.jp
http://www.coe-stemcell.keio.ac.jp/jp/member/suda.html
http://web.sc.itc.keio.ac.jp/celldiff/
GCOE研究テーマ(役割分担)と研究計画
幹細胞は、多分化能と自己複製能をもち、それらは、生涯、器官が機能し続けるのに必須の属性である。幹細胞はニッチとよばれる特別な微小環境に存在する。幹細胞はニッチに接着し、幹細胞性を維持するために、多くのシグナル伝達がある。幹細胞とそのニッチの理解を深めるために、我々は、造血幹細胞、生殖幹細胞および神経幹細胞の増殖・分化のメカニズムを明らかにする。幹細胞を分離し、試験管ないで培養し、また、それらを移植することにより、検討を進める。我々は、すでにニッチに依存してユニークな現象を見せるいろいろな幹細胞に共通して発現する分子を同定している。これらの実験的モデルと解析を通して、再生医療において、幹細胞とそのニッチの相互作用を基盤とした新しい治療法を開発することを目指している。
学歴
1974年 |
横浜市立大学医学部卒業 |
職歴
1974年- |
神奈川県立こども医療センター・小児科・レジデント |
1978年- |
自治医科大学血液医学研究施設造血発生部門・助手 |
1982年- |
サウスカロライナ医科大学内科(小川真紀雄教授)留学・リサーチアソシエイト |
1984年- |
自治医科大学血液医学研究部施設造血発生部門・講師 |
1991年- |
同血液学・助教授 |
1992年- |
熊本大学医学部遺伝発生医学研究施設・分化制御部門・教授 |
2000年- |
熊本大学発生医学研究センター・センター長 |
2000年- |
同・器官形成部門 造血発生分野・教授 |
2002年4月- |
慶應義塾大学・医学部・発生分化生物学講座・教授 |
賞罰
1991年 |
ベルツ賞受賞 |
免許・学位
1974年 |
医師免許証取得 |
1985年 |
医学博士取得(自治医科大学) |
1994年 |
血液学会認定医および指導医 |
受賞・特許
- 特願2004-351813 抗肥満薬
須田年生 他3名
学校法人慶應義塾、山之内製薬株式会社 - 特願2004-172057 幹細胞自己複製促進剤
須田年生 他3名
学校法人慶應義塾、協和発酵工業株式会社
2004年6月10日(出願中)
学会および社会活動
平成12年度-16年度 日本学術振興会未来開拓学術研究
「体性幹細胞の単離・操作と組織再構築に関する研究」プロジェクトリーダー
日本血液学会・評議員
日本臨床血液学会・評議員
American Society of Hematology: "Blood" Editorial Board
"Stem Cells":Editorial Board
International Society for Experimental Hematology:Member of ISEH Standing Scientific Program Committee
造血幹細胞の未分化性維持の分子機構を解明することは、単に造血だけではなく、皮膚・消化管などの幹細胞システムをもつ臓器の再生に応用していく上で、重要な研究として位置づけられる。造血幹細胞の単離された現在、造血幹細胞の試験管内増幅をはかり、幹細胞移植の確立をめざす。さらに、幹細胞の未分化性維持の機構を解明し、幹細胞制御を可能にする。
須田は、1982-84年のサウスカロライナ医科大学留学(小川真紀雄教授)時代に、造血前駆細胞の分化様式を、paired daughter cellを用いて解析し、細胞系列の分化決定は、外からの造血因子によるのではなく、細胞自身の内的プログラムによって、確率論的に決定されるモデルを示した。さらにIL-3,IL-5などのサイトカインの機能解析を単細胞無血清培養法で検討し、各サイトカインの標的細胞を明らかにし、造血系に自己複製することができる幹細胞 (Stem Cell)、分化方向が決定した前駆細胞 (Precursor Cell)、機能をもつ成熟細胞(Mature Cell)というヒエラルキーがあることを示した。その後、蛍光励起細胞分離装置(FACS)を用いた造血幹細胞の純化の研究を進め、受容体型チロシンキナーゼKITの抗体を用いて、造血再建可能な幹細胞の同定に成功した。造血幹細胞は、有核細胞10万個に1個の頻度でしか存在しないが、多様な単クローン抗体を組合わせることにより純化が進み、1個の細胞として明示できるようになった。1992年からは、この幹細胞の増殖・分化を可能にしている分子、ことに受容体型チロシンキナーゼを中心に、その機能解析を試みた。FACSを用いて精製した造血幹細胞から、TIE2/TEK, EphB4/HTKをクローニングした。両分子ともに造血幹細胞のみならず、血管内皮細胞にも発現しており、「造血発生と血管新生の相互作用」について、新しい研究領域を開拓することができた。造血発生は、血管新生と緊密な関係にあり、造血細胞と血管内皮細胞の共通祖先細胞としてヘマンジオブラストが存在する直接的証拠を単細胞培養で示した。造血幹細胞自体、アンジオポエチンー1を産生し、そのオートクラインループは、幹細胞の自己複製に関与している可能性が示唆される。一方、造血幹細胞が、アンジオポエチンー1を介して胎生期血管新生に重要な役割を果たしていることを示し、幹細胞が血管新生を誘導して組織形成をする(Vascular Niche)というモデルを提唱している。「造血は、なぜ血管内で発生し、骨髄で営まれるか」という生理学的課題に答える形で、体性幹細胞研究を展開し、その中で幹細胞の可塑性、各組織幹細胞の異同、幹細胞の自己複製能という命題を解明していきたい。同時にこれらの基礎的成果をもとに、幹細胞移植などの臨床応用に展開したいと考え、研究を進めている。
研究室紹介
我々が知りたいことは、「幹細胞とはなにか」、「組織、たとえば骨髄(血液・血管・骨)は、どのようにしてつくられるか」であります。
研究は、最前線でやっているひとのものであり、各人が、もっとも面白いと思うことに挑戦すべきです。そのとき大切なことは、小学校高学年に分かるような説明を心がけること(単純明快であること)、すぐに役立つことを目指すのではなく、教科書に残るような事実を発見し、論理を構築することだと思います。そのためには、研究室の内外のひとと活発に意見交換をし、常に自分を刈り込む必要があります。自分の意見を言わないかぎり、相手から得られる情報も少なく、一緒に研究をしている意味は失われます。
武満徹が書いています。「人がほんとうに自立するためには、長い時間が必要である。私は、その『時間の園丁』であればよい」と。園丁たちの研究室になれば最高です。若い時代の貴重な4年間あるいは修士からの6年間、研究の醍醐味を味わって、悔いのない時間を過ごしてほしいと考えています。
基本的には、生命現象の不思議の解明をめざし、個体レベル、細胞レベル、蛋白、遺伝子レベルで解析を進めます。具体的には、遺伝子改変マウスの作製、 FACSを用いた細胞分離、細胞培養、分子生物学的研究の技術を習得する、仮説の構築とその検証を通して論理的考え方を訓練する、論文を作成しエキスパートの批判を受ける、学会・セミナーなどで発表し自他のデータを議論する能力を身につけることを目標とします。現在、本教室はスタッフ10人、博士課程12人、修士課程1人、研究支援者5人の体制で以下の3研究プロジェクトを遂行しています。
A.幹細胞システム
幹細胞は、多くの種類の細胞に分化する"多分化能"、さらに自己と同じ能力を持つ幹細胞を造り出す"自己複製能"という二つの能力を持つ。私たちは、いかに幹細胞が自己複製能を維持し、多分化能を保つのか、その謎を解き明かすことを目標にしている。最近、造血系のみならず神経、皮膚、前立腺など各種組織幹細胞の存在が明らかになったが、これらの幹細胞に共通の自己複製能の制御機構が存在すると考えられる。造血幹細胞研究は、研究の歴史が長く、幹細胞の純化や自己複製能の評価法など、他の幹細胞にくらべて、より正確な実験系の構築が可能である。造血幹細胞で得られた知見を基に、幹細胞の本質を知りたいと願っている。
- 細胞の自己複製を支える分子基盤:ニッチの解析
- 造血幹細胞の細胞周期・分裂制御
- 生殖幹細胞の未分化性維持
- 白血病幹細胞の同定とその解析
B.血管システム
最近の研究により、成体での様々な病態に関連する血管新生の場でも、個体発生で見られる血管系システムの構築に関与する分子の多くが用いられていることが明らかとなってきている。私たちは血管網の形づくり及びその過程での血管細胞の分化・多様化に焦点を当て研究を展開している。血管系幹細胞の増殖、動脈、静脈、リンパ管内皮細胞への分化決定、分化決定後のそれぞれの内皮細胞の特徴の解析を通して、血管システムの構築を理解する。血管の再構築ともいうべきリモデリングの分子基盤を解明し、糖尿病性血管病変・腫瘍血管の制御などに貢献していきたい。
- ヘマンジオブラストから造血細胞、血管内皮細胞への分化制御
- 血液細胞と血管内皮細胞の相互作用
- 動・静脈・リンパ管内皮細胞の分化制御
- 腫瘍血管・リンパ管新生の制御とがん転移抑制
C.造骨プロジェクト
骨はどのように形成され、また強く維持されるのか。胎生期や成長期と異なり、成人においては大きく骨が成長することはない。しかし、成人においても骨組織は硬く完成された組織ではなく、リモデリングと呼ばれる再生を繰り返す生きた組織である。リモデリングとは破骨細胞による骨吸収と骨芽細胞による骨新生をもとにした骨の新鮮化であるが、一見骨量を減らすと思われる破骨細胞による骨吸収も、引き続き骨芽細胞を刺激し活性化することで骨新生に貢献する。この破骨細胞による造骨刺激効果のメカニズムは未だ解明されておらず、これを明らかにするべくプロジェクトを展開している。破骨細胞・骨芽細胞・軟骨細胞に特異的に発現する分子を同定し、その機能を解明し、骨・軟骨疾患の克服をめざす。
- 破骨細胞の分化制御と破骨細胞による骨芽細胞制御
- 軟骨細胞の分化制御と無血管性の維持機構の解明
- 椎間板(髄核・繊維輪)細胞の分化機構の解明
研究協力者
久保田義顕(COE PD)
仁田英里子(COE PD)
岩崎博子(COE RA)
五明由美子(COE RA)
中村由香(COE RA)
これまでの研究成果
幹細胞の静止期性は、造血幹細胞を維持する上で重要である。造血幹細胞とその微小環境ニッチとの相互作用は、ことに成体骨髄の造血において重要である。
我々は今までに、造血幹細胞が、Tie2/Angiopoietin-1やMpl/Thrombopoietinのシグナルを通じて骨芽細胞に接着することを見出してきた。骨髄移植で、骨髄細胞が減少したときや、抗がん剤が投与されたとき、静止期幹細胞は細胞周期に入り、増殖して前駆細胞を補う。このとき、活性酸素種(ROS)により、N-cadherinが減少し、幹細胞がニッチから放れると考えられる。連続骨髄移植でも、ROSは、上昇し、p38MAPKやp16Ink4a の活性化が幹細胞で見られる。
静止期幹細胞は、骨髄の内骨膜領域にある。サイトカインに反応して増殖するとき、幹細胞が酸素分圧の高い血管領域へ移動すると考えられる。したがって、幹細胞は低酸素状態で、増殖が抑えられていると考えられる。そこで、造血幹細胞の代謝学的特徴を解析する予定である。静止期幹細胞は、ミトコンドリアが少なく、解糖系によってエネルギーを得ていることをHIF-1α/VHLconditional KOマウスを用いて解析する。さらに、がん幹細胞のニッチをターゲットとした治療法の確立を目指し研究を展開したい。
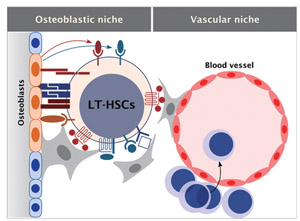
Fig.1 造血幹細胞ニッチ
これまでに造血幹細胞は骨髄内の骨芽細胞や血管周囲に接着して存在することから、骨芽細胞性ニッチと血管性ニッチが同定されている。これらのニッチは互いに相補的な機能を持ち、協調して幹細胞制御に貢献していると考えられる。
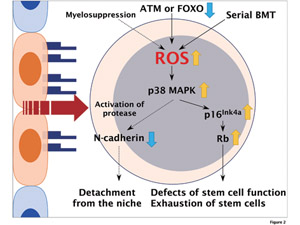
Fig.2 造血幹細胞制御における活性酸素種 (reactive oxygen species: ROS) の機能
造血幹細胞でROSが蓄積すると、p38 MAPKシグナル経路の活性化により、造血幹細胞の自己複製能および静止状態が障害され、幹細胞の枯渇が生じる。また活性酸素の蓄積は造血幹細胞のN-cadherin等の接着分子の発現抑制により、ニッチからの離脱と増殖の誘導にも関わっている。
代表論文
- Arai, F., Hirao, A., Ohmura, M., Sato, H., Matsuoka, S., Takubo, K., Ito, K., Koh, G.Y., and Suda, T. (2004). Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell 118, 149-161.
- Ito, K., Hirao, A., Arai, F., Matsuoka, S., Takubo, K., Hamaguchi, I., Nomiyama, K., Hosokawa, K., Sakurada, K., Nakagata, N., et al. (2004). Regulation of oxidative stress by ATM is required for self-renewal of haematopoietic stem cells. Nature 431, 997-1002.
- Ito, K., Hirao, A., Arai, F., Takubo, K., Matsuoka, S., Miyamoto, K., Ohmura, M., Naka, K., Hosokawa, K., Ikeda, Y., et al. (2006). Reactive oxygen species act through p38 MAPK to limit the lifespan of hematopoietic stem cells. Nat Med 12, 446-451.
- Takubo, K., Ohmura, M., Azuma, M., Nagamatsu, G., Yamada, W., Arai, F., Hirao, A., and Suda, T. (2008). Stem cell defects in ATM-deficient undifferentiated spermatogonia through DNA damage-induced cell-cycle arrest. Cell Stem Cell 2, 170-182.
- Yoshihara, H., Arai, F., Hosokawa, K., Hagiwara, T., Takubo, K., Nakamura, Y., Gomei, Y., Iwasaki, H., Matsuoka, S., Miyamoto, K., et al. (2007). Thrombopoietin/MPL signaling regulates hematopoietic stem cell quiescence and interaction with the osteoblastic niche. Cell Stem Cell 1, 685-697.
Copyright © Keio University. All rights reserved.
