- ホーム
- 拠点リーダーからのご挨拶
- 幹細胞医学とは
- 幹細胞医学教育研究センター
- 5つの領域・サブグループ
- 事業推進担当者一覧
- 若手研究者情報
- COEX MEETING
- プレスリリース(抜粋)/発表論文情報
- KORD[研究者成果登録]
プログラム終了に当たって

佐谷秀行 (さやひでゆき)

慶應義塾大学大学院医学研究科 先端医科学
先端医科学研究所遺伝子制御研究部門教授
Hideyuki Saya, MD, PhD
hsaya@a5.keio.jp
http://genereg.jp/index.html
GCOE研究テーマ(役割分担)と研究計画
癌幹細胞とEMTを標的とした新規癌治療の開発
近年、癌組織は自己複製能を持ち半永久的に子孫細胞を作り続けることのできる『癌幹細胞』と呼ばれる細胞と、最終的には老化・分化・死によって増殖能を失う運命にある細胞の二群から構成されていることが分かってきた。癌幹細胞は放射線や化学療法に対して抵抗性を示すことから、その性状解析は新たな治療を考案する上で極めて重要である。また、発生過程や創傷治癒過程において見られる上皮間葉転換(epithelial mesenchymal transition: EMT)と呼ばれる現象が、癌の浸潤および転移の引き金を引くイベントであることが明らかになり、その機構の解析が急速に進みつつある。私達はこれら2つの新しいパラダイムに基づいた治療戦略を開発することを目的として研究を行う。具体的には、(1)マウス正常細胞に限定された遺伝子操作を加えることにより、100%の確率で、しかも短期間で癌化する動物モデルを作製し、その腫瘍中の癌幹細胞を用いて非癌幹細胞との違いについて解析を行う。そして、2つの細胞間の性質をスイッチできる薬剤の取得を目指す。(2)EMTをin vitroで評価できるcell-based assayを確立し、それを用いてEMT制御分子の同定をおこなう。さらに、低分子化合物をスクリーニングし、抗EMT活性をもつ薬剤の開発を目指す。
これまでの研究成果
動物モデルを用いた癌幹細胞の性状解析と治療標的分子の同定
マウスの正常造血系細胞よりB細胞性白血病を、骨髄由来間葉系細胞より骨肉腫作製することに成功し、その中に治療抵抗性を示すiCSC分画を同定することができた。そして抵抗性を示す細胞と感受性の高い細胞間では、分化度が異なることを見出した。
癌細胞の増殖や運動を生体内で評価するためには、体の内部が観察しやすく、また安価で簡便に増やすことのできる動物モデルが必要となる。私達はこれらの条件を満たすモデルとしてヒストンH2B‐GFトランスジェニックメダカを作製した(Cell Cycle. 2009)。
上皮間葉転換制御シグナルの同定と阻害剤開発
ヒト正常網膜色素上皮細胞を用いてin vitroでEMTを観察できるシステムを構築した。このシステムによりEMTの誘導にはCD44の発現とそれと結合するヒアルロン酸の合成が必要であることを見出した。また、このアッセイ法を用い、EMTを抑制する化合物を得ることができた。
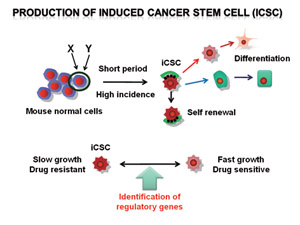
Fig.1 人工癌幹細胞の作製とその性状解析に基づく癌幹細胞に対する新たな治療戦略の開発
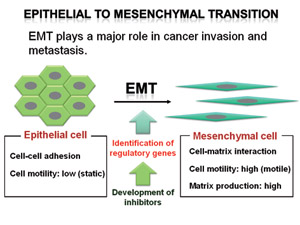
Fig.2 癌細胞における上皮間葉転換(EMT)制御分子の同定とEMT抑制のための新たな治療手段の開発
代表論文
- Sampetrean O, Iida S, Makino S, Matsuzaki Y, Ohno K, Saya H: Reversible whole-organism cell cycle arrest in a living vertebrate. Cell Cycle 8(4): [Epub ahead of print], 2009
- Arima Y, Inoue Y, Shibata T, Hayashi H, Nagano O, Saya H and Taya Y: Rb depletion results in deregulation of E-cadherin and induction of cellular phenotypic changes that are characteristics of the epithelial to mesenchymal transition. Cancer Res 68: 5104-5112, 2008.
- Takahashi A, Ohtani N, Yamakoshi K, Iida S, Tahara H, Nakayama K, Nakayama KI, Ide T, Saya H and Hara E: Mitogenic signalling and the p16INK4a-Rb pathway cooperate to enforce irreversible cellular senescence. Nat Cell Biol 8: 1291-1297, 2006
- Ozawa T, Araki N, Yunoue S, Tokuo H, Feng L, Patrakitkomjorn S, Hara T, Ichikawa Y, Matsumoto K, Fujii K and Saya H: The neurofibromatosis type 1 gene product neurofibromin enhances cell motility by regulating actin filament dynamics via the Rho-ROCK-LIMK2-cofilin pathway. J Biol Chem 280: 39524-39533, 2005
- Nagano O, Murakami D, Hartmann D, De Strooper B, Saftig P, Iwatsubo T, Nakajima M, Shinohara M and Saya H: Cell-matrix interaction via CD44 is independently regulated by different metalloproteinases activated in response to extracellular Ca2+ influx and PKC activation. J Cell Biol 165: 893-902, 2004.
Copyright © Keio University. All rights reserved.
