- ホーム
- 拠点リーダーからのご挨拶
- 幹細胞医学とは
- 幹細胞医学教育研究センター
- 5つの領域・サブグループ
- 事業推進担当者一覧
- 若手研究者情報
- COEX MEETING
- プレスリリース(抜粋)/発表論文情報
- KORD[研究者成果登録]
プログラム終了に当たって

森川康英 (もりかわやすひで)

慶應義塾大学大学院医学研究科 外科学(小児外科) 教授
Yasuhide Morikawa, MD, PhD
ymorikaw@sc.itc.keio.ac.jp
http://web.sc.itc.keio.ac.jp/surgery/ps/index.html
GCOE研究テーマ(役割分担)と研究計画
難治性疾患の再生医療の開発
"Development of Regenerative Medicine for Intractable Diseases"
「ヒルシュスプルング病に対する神経堤幹細胞移植」
Investigation of neural crest stem cell therapy for Hirschsprung's disease
ヒルシュスプルング病(以下本症)とは、新生児期に便秘、腹部膨満を主訴とする疾患で、その本態は消化管の神経節細胞の欠如である。神経節細胞は神経堤をその起源とし、腸管壁内を口側から肛門側に向けて移動していく過程において何らかの原因によって移動が停止することで本症が発症すると考えられている。
神経堤細胞は各組織に分化・成熟した後も、少数は未分化な状態で潜伏し、組織の修復、維持に関与していると考えられており、そうした細胞は神経堤幹細胞(NCSCs: Neural crest stem cells)と呼ばれている。我々のグループはこれまで、手術が唯一の治療手段であるヒルシュスプルング病に対する新しい治療法として、小腸移植を臨床例において実施してきたが、さらに本症の病因により迫る治療法として神経堤幹細胞移植による再生医療の可能性を検討してきた。本研究グループではまず胎生マウスの腸管から神経堤幹細胞を分離し、さらにそのsphereを用いることで腸管疾患への移植治療の可能性を検討し、同時に疾患モデルマウスならびに臨床検体を用いた神経堤幹細胞移植実験を計画している。
これまでの研究成果
実験は、マウスおよびヒト臨床検体を用いて行っている。
先ず、マウス胎仔腸管からの神経堤幹細胞の分離を試みた。この際、神経堤由来の細胞がGFPでラベルされたマウスを用いて、効率よく神経堤由来細胞の回収を行った。得られた神経堤由来の細胞を培養し、その自己増殖能を確認するとともに、神経堤幹細胞の特徴である、神経、グリア、平滑筋への多分化能を確認した。自己増殖能と多分化能から、神経堤幹細胞の存在が確認された。
次に、自己増殖した細胞塊をマウス胚腸管に移植したところ、神経堤細胞が腸管内に移動し、生着することが観察された。それらの細胞はGFPおよび神経マーカーであるPGP9.5陽性であったことから、生着した神経堤細胞が神経へと分化していると考えられた。
ヒト腸管臨床検体においても、培養細胞中に自己増殖してくる細胞が存在し、それらが神経、グリア、平滑筋への多分化能を有することを確認している。
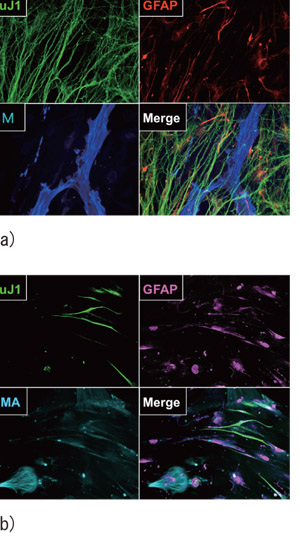
Fig.1 マウスおよびヒト神経堤細胞由来sphereの多分化能
(a) マウス神経堤由来sphereが神経マーカー(Tuj1)、グリア細胞マーカー(GFAP、平滑筋マーカー(SMA)陽性の細胞に分化した。
(b) ヒト神経堤由来sphereが神経マーカー(Tuj1)、グリア細胞マーカー(GFAP、平滑筋マーカー(SMA)陽性の細胞に分化した。
代表論文
- Watanabe T, Hoshino K, Tanabe M, Morikawa Y, Kawachi S, Wakabayashi G, Shimazu M, Kitajima M.:Correlation of motility and neuronal integrity with a focus on the grade of intestinal allograft rejection. Am J Transplant. 2008 Mar;8(3):529-36. Erratum in: Am J Transplant. 2008 Jun;8(6):1355. Am J Transplant. 2008 Jun;8(6):1356.
- Komori K, Fuchimoto Y, Morikawa Y, Obara H, Kawachi S, Tanabe M, Hoshino K,Shimazu M, Matsuzaki Y, Kitajima M.:The role of graft and host accommodation in a hamster-to-rat cardiac transplantation model. Transplantation. 2008 Jan 15;85(1):112-7.
- Oguma J, Ozawa S, Morikawa Y, Furukawa T, Kitagawa Y, Ueda M, Kitajima M.:Knot-tying force during suturing and wound healing in the gastrointestinal tract. J Surg Res. 2007 Jun 1;140(1):129-34.
- Yamayoshi Y, Watanabe T, Tanabe M, Hoshino K, Matsumoto K, Morikawa Y,Shimadzu M, Kitajima M, Tanigawara Y.:Novel application of ProteinChip technology exploring acute rejection markers of rat small bowel transplantation. Transplantation. 2006 Aug 15;82(3):320-6.
- Shimojima N, Nakaki T, Morikawa Y, Hoshino K, Ozaki H, Hori M, Kitajima M.:Interstitial cells of Cajal in dysmotility in intestinal ischemia and reperfusion injury in rats. J Surg Res. 2006 Oct;135(2):255-61.Epub 2006 Jul 26.
Copyright © Keio University. All rights reserved.
